TIL细胞是天然存在于肿瘤微环境中的免疫细胞,能够识别并攻击癌细胞。
在肿瘤治疗领域,TIL 疗法是被很多专家看好的一种颠覆性技术。
2024年 2 月,一家美国企业研发的 TIL 疗法lifileucel获美国食品药品监督管理局(FDA)批准上市,用于治疗晚期黑色素瘤,成为全球首个获批上市的 TIL 疗法,也是全球首个获批用于实体瘤的 T 细胞疗法,标志着实体瘤治疗有了新式“武器”。

01
什么是TIL疗法?
TIL疗法,全称是肿瘤浸润淋巴细胞(TIL)疗法。这是一种拥有30多年历史的肿瘤免疫疗法。
它来源于分离患者肿瘤组织中的肿瘤浸润淋巴细胞(TIL),在实验室中,这些细胞会被扩增和激活,然后回输到患者体内,以增强对肿瘤的免疫反应。
由于这些TIL细胞是天然存在于肿瘤微环境中的免疫细胞,因此能够识别并攻击癌细胞。
02
细胞疗法中,TIL和CAR-T区别?
近年来,过继性细胞免疫治疗改变了癌症免疫治疗的格局。过继性细胞免疫治疗主要通过向体内回输具有抗肿瘤活性的免疫细胞,从而达到抗肿瘤的目的。
目前过继性细胞免疫治疗主要有 3 种类型:
肿瘤浸润性淋巴细胞(TIL)
T 细胞受体修饰 T 细胞(TCR-T)
嵌合抗原受体 T 细胞(CAR-T)
国内目前仅有CAR-T产品获批,并且获批适应症均为血液肿瘤(例如白血病、淋巴瘤和多发性骨髓瘤)。
与目前已获批的CAR-T一样,TIL是使用患者自身的T细胞制成的。但不同的是:CAR-T的T细胞是从患者的循环血液(外周血)中收集的;TIL的T细胞是从患者的肿瘤中收集的。
另一方面,一个关键的区别是,CAR-T需要将收集的T细胞在实验室中进行基因工程改造,使它们具有识别癌细胞的能力,而TIL没有经过基因修饰,因为它们已经具备识别癌细胞的能力。
03
TIL疗法制备和治疗过程?
1. 手术切除肿瘤样本:首先,医生会从患者体内切除一小块肿瘤组织。
2. TIL的制备:
分离TIL:在实验室中,从肿瘤组织中分离出TIL。
扩增TIL:在实验室中,通过特定的培养条件,使TIL数量增加到足够的治疗剂量。
激活TIL:通过添加刺激因子,通常是白细胞介素2(IL-2),提高TIL的活性和攻击能力。
3. 患者准备:患者可能需要接受一些预处理,以创造一个更有利于TIL发挥作用的环境。
4. 回输TIL:将扩增后的TIL通过静脉注射的方式输回患者体内,它们会寻找并攻击肿瘤细胞。
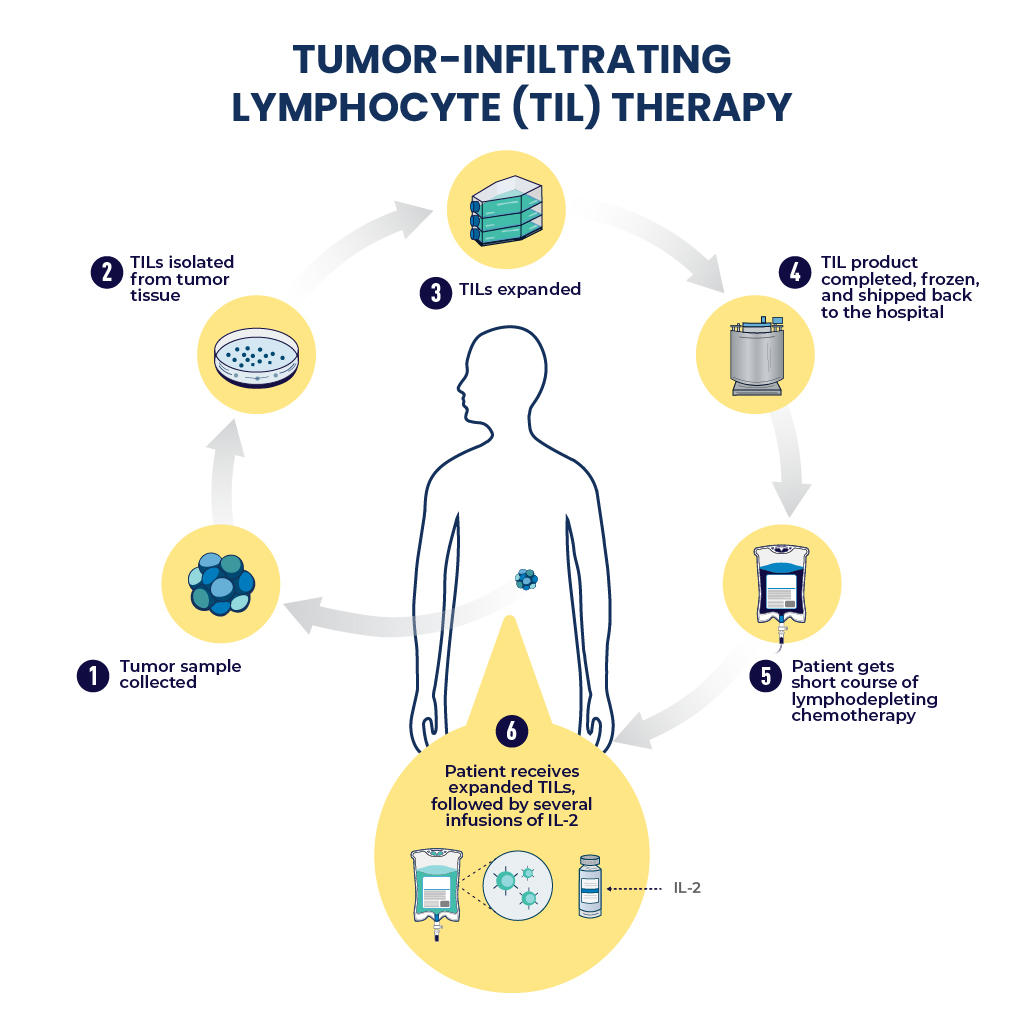
TIL疗法的治疗过程(图片来源:NCI)
TIL疗法已在国外获批
适应症为黑色素瘤
2024年2月,Iovance Biotherapeutics公司的TIL疗法lifileucel获FDA加速批准上市,成为全球首款TIL细胞疗法,用于治疗晚期黑色素瘤。据悉,该疗法的定价为51.5万美元(约370万人民币)。
Lifileucel的批准是基于2期C-144-01临床试验的结果。结果显示:
在接受FDA最终批准的lifileucel剂量治疗的70多名参与者中,近三分之一患者的肿瘤大小至少有所减小(肿瘤缓解),在一些患者中肿瘤完全消失(完全缓解)。此外,在接受一次性输注治疗一年后,大约40%对lifileucel有缓解的患者仍然没有疾病进展。
该试验的所有参与者都有由治疗引起的副作用。然而,大多数并不危险,主要是由lifileucel输注前给予的化疗和之后给予的 IL-2 引起的。最常见的症状包括贫血、高烧以及血小板和某些白细胞水平大幅下降。
另一方面,TIL疗法似乎不会引起在接受CAR-T疗法治疗的人中常见的严重免疫相关副作用,包括细胞因子释放综合征和神经系统影响。
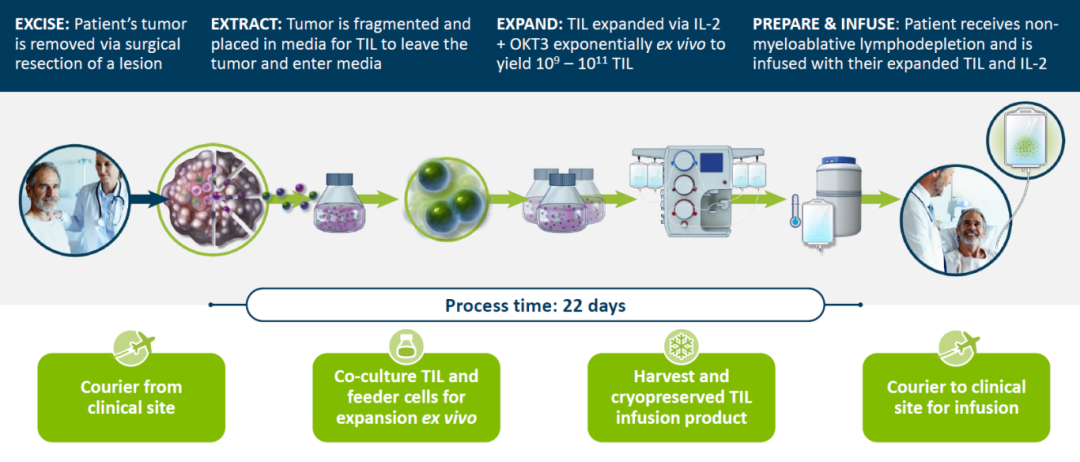
Iovance专有的TILs制造工艺
(图片来源:Iovance公司官网)
TIL疗法有望用于多种实体瘤
下一代TIL疗法正在探索中
在大多数TIL疗法的临床试验中,黑色素瘤仍然是头号肿瘤类型。到目前为止,TIL疗法在转移性黑色素瘤和晚期宫颈癌中已经显示出令人印象深刻的临床益处,甚至在使用检查点抑制剂治疗的患者中也是如此。
除此之外,TIL疗法在其他实体瘤中也有成功应用,已经在结直肠癌、非小细胞肺癌和乳腺癌等癌症中显示出初步疗效。
TIL疗法对宫颈癌患者也显示出显著的临床获益。一项2期临床试验评估了LN-145在放化疗后进展的晚期宫颈癌患者中的安全性和有效性。
在27 例可评估的患者中,44%患者获得肿瘤缓解,其中完全缓解率为 11%,疾病控制率高达 85%,且没有发生严重的治疗相关不良事件。
2019 年 6 月,美国FDA基于这项研究数据,授予 TIL 疗法 LN-145“突破性疗法称号”。
02 结直肠癌
在一项2期临床试验中,一名50岁KRAS突变型转移性结直肠癌女性接受单次输注TIL,该患者的所有转移病灶均实现了消退,并实现了9个月的部分缓解。
这些TIL是从她肺部病灶切除的肿瘤组织中,提取并筛选的,其中75%是由可特异性识别突变KRAS G12D的CD8+ T细胞,这些细胞可精准杀伤她体内的肿瘤细胞。
03 非小细胞肺癌
2020年有报道称,PD-1抑制剂联合TIL疗法治疗NSCLC初步见效。在这项第一阶段试验中,纳武利尤单抗治疗后进展的转移性 NSCLC 患者接受 TIL 治疗。
患者接受 TIL 和 IL-2 输注,然后接受纳武利尤单抗以增强 TIL 的持久性。13 名可评估患者中,有 2 名获得了持久的完全缓解。
这项临床试验的激动人心的结果为抗PD-1治疗后进展的患者带来了希望,并表明TIL疗法联合PD-1抑制剂可能是转移性NSCLC患者的有前途的选择。
04 乳腺癌
2018年,Zacharakis等人报道了激素受体阳性转移性乳腺癌患者在接受TIL疗法和抗PD-1单克隆抗体联合治疗后,肿瘤完全且持久地消退。
为了克服TIL治疗的一些限制,研究人员探索了通过基因工程改造TIL的方法,这类合成TIL(Synthetic TIL)相比于传统的肿瘤浸润淋巴细胞(TIL)治疗,具有以下优势:
增强的细胞毒性:
通过基因工程,合成TIL可以被改造以分泌增强细胞毒性的蛋白,如肿瘤坏死因子(TNF)和肿瘤坏死因子相关凋亡诱导配体(TRAIL),这有助于提高对肿瘤细胞的杀伤能力。
改善的肿瘤归巢能力:
合成TIL可以被设计为表达特定的趋化因子受体,例如CXCR2,这有助于它们更有效地迁移到肿瘤部位。
减少T细胞耗竭:
通过基因编辑技术,如锌指核酸酶(ZFN),合成TIL可以减少PD-1等抑制性受体的表达,从而减少T细胞耗竭,提高其持久性和活性。
个性化治疗:
合成TIL可以根据患者的肿瘤特征进行个性化设计,以对抗特定的肿瘤逃逸机制。
潜在的更广应用范围:
合成TIL可能在传统TIL治疗效果不佳的肿瘤类型中表现出更好的疗效。
LIFE SEEK
写在最后
TIL疗法的主要优势在于其高度个性化的治疗方法,能够利用患者自身的免疫细胞,针对特定的肿瘤进行治疗,减少了治疗不适应的风险,并且在攻击肿瘤细胞的同时,对正常细胞的损伤相对较小,从而减轻了患者的副作用和不良反应。
尽管面临一些挑战,TIL疗法的发展前景还是充满希望,未来可能成为对抗各类实体瘤的重要武器。
部分图片来自网络,侵删
参考资料:
[1] 俞陶然.“平民价”癌症TIL疗法进入临床试验[N].解放日报,2024-06-18(002).
[2] 张蓝月,申复进.过继性细胞免疫治疗在宫颈癌中的研究进展[J].国际妇产科学杂志,2024,51(03):253-257.
[3] https://www.cancer.gov/news-events/cancer-currents-blog/2024/fda-amtagvi-til-therapy-melanoma
[4] https://cancerfax.com/tumor-infiltrating-lymphocyte-til-therapy/
[5] Rohaan MW, Borch TH, van den Berg JH, et al. Tumor-Infiltrating Lymphocyte Therapy or Ipilimumab in Advanced Melanoma. N Engl J Med. 2022;387(23):2113-2125.
[6] Jiménez-Reinoso A, Nehme-Álvarez D, Domínguez-Alonso C, Álvarez-Vallina L. Synthetic TILs: Engineered Tumor-Infiltrating Lymphocytes With Improved Therapeutic Potential. Front Oncol. 2021;10:593848.
关于生命求索
作为国内实现「细胞技术+AI+临床服务+软硬件解决方案+人才培养」全链条赋能的平台型企业,生命求索依托深厚行业积淀的专家团队与自主创新技术体系,提供细胞产、学、研、用整体解决方案。
科研成果转化产品主要有:细胞智能方舱实验室、TIL细胞疗法、免疫细胞、干细胞、外泌体等。
旗下大模型平台: LIFESEEK 生命求索--国内基于Deep Seek的细胞产业全链条AI大模型平台。
