胰岛细胞具备调控血糖的能力,在糖尿病治疗方面具有巨大价值,是多能干细胞定向分化研究的焦点之一。
胰岛细胞具备调控血糖的能力,在糖尿病治疗方面具有巨大价值,是多能干细胞定向分化研究的焦点之一。
01
胰岛细胞在
糖尿病治疗方面应用
2025 年 8 月 8 日,北京大学、北大-清华生命科学联合中心邓宏魁课题组在国际学术期刊 Cell Stem Cell 发表题为「Reconstruction of Endocrine Subtype-complete Human Pluripotent Stem Cell-derived Islets with Capacity for Hypoglycemia Protection in vivo」的最新研究成果。该研究首次利用人多能干细胞成功分化构建了内分泌细胞类型完备的胰岛。
这些胰岛能够高效响应血糖浓度变化,不仅能够有效降低血糖,更具备关键的升血糖功能,在糖尿病小鼠模型中展现出有效的低血糖防护能力,解决了干细胞来源的胰岛细胞类型及功能不全面的难题。

本报道原始论文首页截图
胰岛细胞具备调控血糖的能力,在糖尿病治疗方面具有巨大价值,是多能干细胞定向分化研究的焦点之一。
邓宏魁团队经过二十余年系统研究,在这一领域取得了一系列突破。早在 2005 年,邓宏魁团队率先采用「体外分化模拟体内发育」策略,实现了小鼠多能干细胞向胰腺 β 细胞定向分化(Stem Cells, 2005);2007 年,团队报道了首个化学成分明确的人胚胎干细胞向胰岛细胞的定向分化方案(Cell Res., 2007);此后,团队进一步实现了诱导多能干细胞(iPS 细胞)向胰腺 β 细胞的定向分化(Cell Res., 2009);2022 年,团队在人多能干细胞制备方面取得重大突破,实现化学小分子诱导人多能干细胞(CiPS 细胞),为胰岛细胞分化提供了全新的种子细胞来源。
邓宏魁团队以人 CiPS 细胞为起点,在不同供体来源的人 CiPS 细胞系上实现了稳定、高效的胰岛细胞诱导,并在恒河猴糖尿病模型中验证了人 CiPS 细胞来源的胰岛细胞治疗糖尿病的安全性和有效性(Nat Med., 2022)。团队还创新性地建立了腹直肌前鞘下移植新策略,较传统移植方法创伤更小、操作简便、易于长期追踪观察,移植后胰岛存活和功能显著提升(Nat Metab., 2023)。
在充分开展临床前研究基础上,2023 年 6 月,天津市第一中心医院沈中阳、王树森研究组,北京大学、昌平实验室邓宏魁研究组,和杭州瑞普晨创科技有限公司合作,正式获批国家干细胞临床研究备案(备案号:MR-12-23-017130),开展了人 CiPS 细胞来源的胰岛细胞移植治疗 1 型糖尿病的 IIT 临床研究。
首位患者在移植后恢复了内源自主性、生理性的血糖调控,移植 75 天后完全稳定地脱离胰岛素注射治疗,目前疗效已稳定持续 2 年以上,初步证明了基于化学重编程技术的胰岛细胞疗法安全有效(Cell, 2024)。

在干细胞来源的胰岛临床转化的关键阶段,研究团队进一步深入研究了保障安全性的策略。在胰岛功能方面,传统方案都聚焦于如何分化胰岛中分泌胰岛素的 β 细胞,具备降低血糖的功能。然而,天然胰岛是由 5 种内分泌细胞构成(β、α、δ、PP、ε 细胞),不仅包括 β 细胞,还包括了分泌胰高血糖素的 α 细胞以及分泌生长抑素的 δ 细胞等。多种内分泌细胞的构成不仅赋予了胰岛降低血糖的作用,还具备升高血糖的功能(血糖反向调节),从而构建血糖稳态。
临床数据显示,80% 的 1 型糖尿病患者存在低血糖症状,其中 20%-45% 会发生危及生命的严重低血糖,导致死亡率增加 3.4 倍。因此,低血糖防护对糖尿病患者至关重要,人多能干细胞分化的胰岛是否具备双向血糖调控及预防低血糖的能力,此前尚未充分研究。
本研究中,团队通过表观小分子调控乙酰转移酶(HAT)P300/CBP 活性,创新性地建立了非 β 内分泌细胞的高效诱导方案,结合重聚集技术成功构建了包含全部 5 种内分泌亚型的「重建胰岛」(图 2),通过调控重建胰岛中 5 种内分泌细胞的配比,解决了多能干细胞分化胰岛细胞类型缺失、胰岛功能不完善的问题。
值得一提的是,β 细胞和非 β 细胞分别产生于独立的「胰岛芽」,再整合成功能性胰岛的策略,与人胰岛自然发育过程相似(J. Histochem. Cytochem., 2009; J. Clin. Endocrinol. Metab., 2012; Dev. Growth Differ., 2016),揭示了功能性内分泌细胞分化的规律。
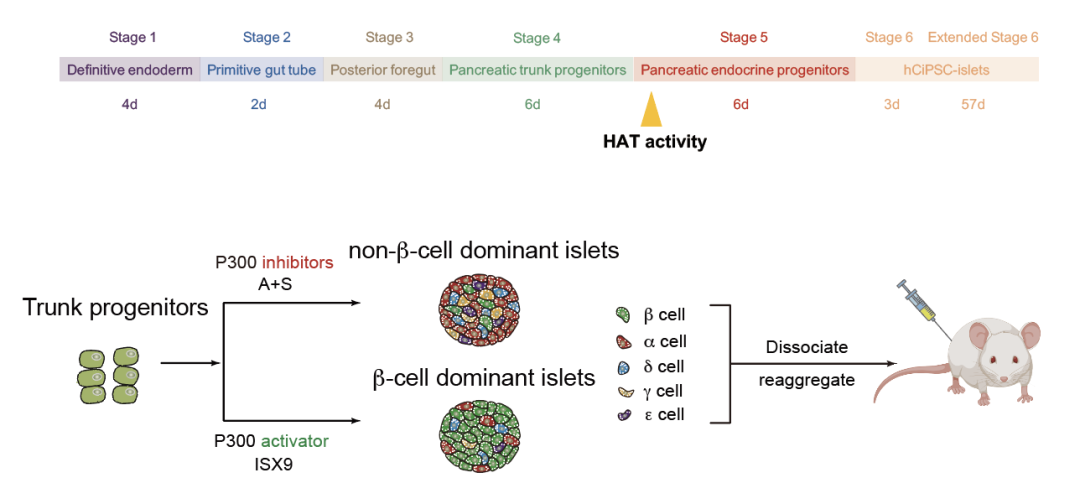
体外构建内分泌亚型完备的重建胰岛,评估胰岛内分泌组成对血糖调控的影响
团队利用 1 型糖尿病小鼠模型验证了重建胰岛的功能,并取得三项重要发现:
1. 首次阐明胰岛细胞组成与血糖水平的定量关系,证实优化组成的重建胰岛更好维持生理性血糖水平;
2. 揭示非 β 细胞(特别是 α 和 δ 细胞)的低血糖防护功能,在胰岛素过量或禁食条件下能有效避免低血糖发生;
3. 通过高胰岛素-低血糖钳夹实验证实,重建胰岛可恢复机体的低血糖反向调节反应,包括更显著的 C 肽分泌「刹车」、胰高血糖素分泌激活和反向调节激素(如肾上腺素)的协同响应。
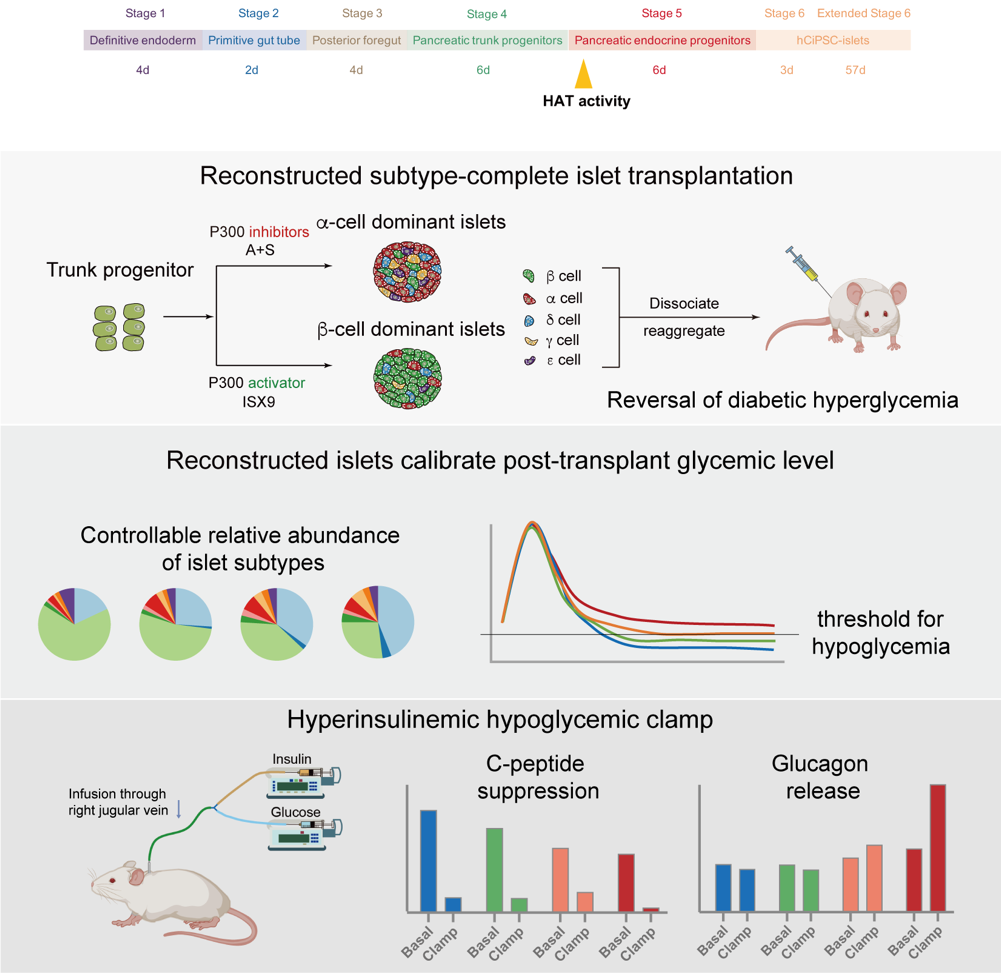
整合非 β 细胞的重建胰岛能有效避免低血糖,恢复机体的低血糖反向调节反应
该研究基于人多能干细胞建立了首个可精确调控 5 种内分泌细胞比例的胰岛制备体系,实现了通过工程化定制胰岛细胞组成,重现天然胰岛的双向血糖调控功能,为移植后实现精准血糖稳态调控、避免低血糖风险奠定了基础。这一进展为干细胞来源胰岛的临床转化提供了进一步的安全保障,有助于加速糖尿病细胞治疗的临床应用进程。
北京大学和杭州瑞普晨创孟高帆、顾佳斌、廖顺意和曹靖宵为该研究的共同第一作者。北京大学博雅讲席教授、昌平实验室领衔科学家、北大-清华生命科学联合中心邓宏魁教授,杭州瑞普晨创孟高帆博士是这一研究成果的共同通讯作者。南京医科大学第一附属医院周红文教授、付真真博士,北医三院王金琳博士,天津市第一中心医院王树森研究员,北京大学李程教授为本研究提供了重要帮助。本工作获得了北京市自然科学基金、浙江省「尖兵」「领雁」研发计划、国家重点研发计划和国家自然科学基金等支持。
02
化学中编程技术:
干细胞治疗的新范式
2025 年 7 月 30 日,北京大学、北大-清华生命科学联合中心邓宏魁课题组与北京大学关景洋课题组合作,在国际学术期刊 Cell Stem Cell 上发表了题为「Chemical Reprogramming of Human Blood Cells to Pluripotent Stem Cells」的最新研究成果。
该研究首次实现了利用化学方法将人血液细胞诱导为多能干细胞,克服了化学诱导多能干细胞制备中起始细胞来源的关键瓶颈,将进一步推动化学诱导多能干细胞技术的可及性。

本报道原始论文首页截图
多能干细胞(Pluripotent stem cells)具有自我更新及分化成不同功能细胞的潜力,是再生医学的核心种子细胞。化学重编程技术是一种新型的细胞命运重编程方法,它利用化学小分子组合来精准操控细胞命运,为多能干细胞的制备提供了全新的途径。邓宏魁团队于 2013 年首次实现了完全利用化学小分子将小鼠体细胞重编程为多能干细胞(Science,2013)。
相比于传统的转录因子重编程策略,小分子重编程提供了更灵活、更简便的细胞命运调控方式。该团队后续还深入地系统性阐述了化学重编程的独特分子路径(Cell, 2015; Cell Stem Cell, 2018),揭示了化学重编程技术与传统转基因重编程策略在机制上的本质差异。
2022 年,邓宏魁团队成功将该技术应用于人体细胞,首次制备了化学诱导人多能干细胞(hCiPS 细胞),这一突破为化学重编程技术应用于人体疾病治疗奠定了基础(Nature,2022)。随后,该团队开发了更加高效、化学成分明确的 hCiPS 细胞诱导体系,使该技术制备的多能干细胞更符合临床应用需求(Cell Stem Cell, 2023)。
近期,通过克服关键的表观遗传障碍,团队进一步建立了快速的化学重编程平台,能高效地将人成体细胞转化为 hCiPS 细胞(Nature Chemical Biology, 2025)。
值得注意的是,人体细胞化学重编程过程经历分阶段诱导,在此过程中会产生短暂激活的、模拟逆向发育通路的类再生状态(Cell Reports, 2023; Cell Stem Cell, 2024)。这一机制进一步揭示了化学重编程的独特原理,使其成为一个高效可控的细胞命运调控体系,在临床方面具有广阔应用前景。
化学诱导人多能干细胞的应用前景
尽管在人体细胞化学重编程领域取得了诸多进展,但仍然存在一个重要挑战:寻找理想的用于重编程的人体细胞来源。皮肤成纤维细胞和脂肪基质细胞虽为常用来源,但其他类型的体细胞 —— 特别是人类血细胞 —— 能否通过化学重编程成功转化为 hCiPS 细胞,此前仍是未知数。
与其它体细胞类型相比,血液细胞是最易获取、最便捷且近乎无限的组织来源。采血程序成熟、不易污染且对患者和捐献者侵入性小。
更重要的是,血库中储存着大量可用于研究和应用的冻存血液样本。因此,开发一种能够从血液细胞稳定、高效制备 hCiPS 细胞的化学重编程策略具有重要的意义,这将克服现有化学重编程技术的局限,促进其在个体化再生医学中的广泛应用。
本研究中,团队成功克服了化学重编程技术的关键挑战,建立了将人脐带血和成人外周血细胞重编程为 hCiPS 细胞的方法。这一新型化学重编程体系,可以在 20 天内诱导单孔数百个 hCiPS 克隆的产生,最快仅需 12 天诱导。同时,该技术方案还可以稳定地从冷冻保存的血细胞诱导获得 hCiPS 细胞,为利用大型外周血库和脐带血库规模化制备 hCiPS 细胞系奠定了基础。
值得注意的是,团队还成功建立了基于少量指尖采血获得的细胞重编程为 hCiPS 细胞的体系,为大规模构建 hCiPS 细胞库提供了一种简单高效的策略。血液重编程方法显著地拓展了化学重编程技术的应用范围,首次实现了从人体最易获取且最丰富的组织样本中高效制备 hCiPS 细胞。
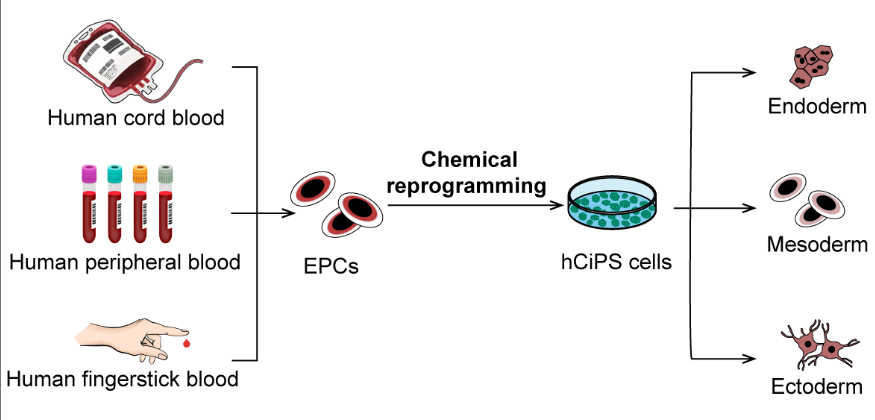
化学重编程诱导不同来源人血液细胞为多能干细胞
血液化学重编程体系代表了新一代的人多能干细胞制备技术,有潜力超越传统的转基因策略。本研究显示,对于同一供体来源的外周血单核细胞,化学重编程方法的效率比传统四因子重编程方法的效率高出 20 倍以上。
此外,化学小分子方法简单易操作,无需递送任何外源基因,便于开发即用型试剂盒,易于广泛应用。相比之下,基于转录因子的方法在血细胞重编程中还存在一定局限。例如基于仙台病毒(sendai virus)和附加体载体(episomal vectors)的重编程方法, 在血液细胞上诱导效率较低,且需要将已建立的细胞系进行多次传代,以消除外源重编程因子,才能用于进一步的应用。相比之下,化学重编程建立的 hCiPS 细胞系无需额外操作即可直接使用。鉴于这些优势,这种有效便捷的血细胞化学重编程方法有潜力成为被广泛使用的平台。
这一技术体系的建立,将进一步加速 hCiPS 细胞技术在临床应用上的推广和应用。近期,邓宏魁和其他课题组报道不同的功能细胞,例如胰腺细胞、肝脏细胞、T-NK 细胞和视网膜色素上皮细胞等,都可以从 hCiPS 细胞高效分化获得。
北京大学彭芳琪、王杨璐、成林、蔡如意、傅筱荻、杨芷涵、程若琦为该研究的共同第一作者。北京大学博雅讲席教授、昌平实验室领衔科学家、北大-清华生命科学联合中心 PI 邓宏魁教授、北京大学药学院关景洋研究员和王杨璐博士是这一研究成果的共同通讯作者。北京大学李程教授、北医三院穆荣主任为本研究提供了重要帮助。本工作获得了国家自然科学基金、北京市自然科学基金、中国博士后科学基金等支持。
LIFE SEEK
写在最后
北大邓宏魁团队的这项研究,让我们看到了再生医学的无限可能。未来,当我们面对疾病时,或许只需抽取几滴血液,就能通过这一神奇的技术,定制出专属的生命“修复工具包”,精准修复受损的身体组织和器官。
这一成果,不仅是中国科学家在干细胞领域的又一次重大突破,更是为全球人类的健康福祉描绘了一幅无比美好的蓝图。相信在不久的将来,随着技术的不断完善和应用,这一愿景将逐渐成为现实,为人类健康带来前所未有的变革。
部分图片来自网络,侵删
关于生命求索
作为国内实现「细胞技术+AI+临床服务+软硬件解决方案+人才培养」全链条赋能的平台型企业,生命求索依托深厚行业积淀的专家团队与自主创新技术体系,提供细胞产、学、研、用整体解决方案。
科研成果转化产品主要有:细胞智能方舱实验室、TIL细胞疗法、免疫细胞、干细胞、外泌体等。
旗下大模型平台: LIFESEEK 生命求索--国内基于Deep Seek的细胞产业全链条AI大模型平台。
