基于自身的特性,间充质干细胞被喻为干细胞中的“孙悟空”,成为了干细胞领域的宠儿。它不仅具有干细胞固有的增殖分化能力,还拥有强大的免疫调节功能。随着科学家们的深入发掘和控制利用,间充质干细胞将能广泛应用于更多疾病的临床治疗中。
作为一种广泛存在于人体的细胞,我们能在骨髓、脂肪、脐带等多种组织中发现MSC的踪迹,“产地”的迥异也引发了科学家们的浓厚兴趣:
“不同组织来源的MSC是否有差异性?这些差异会影响到最终疗效吗?”
间充质干细胞,简称MSC,因其独特的组织修复能力而受到日益重视。在人体内,MSC分布广泛,目前主要的来源包括骨髓、脐带、脂肪等。
虽然不同组织来源的间充质干细胞均能符合2006年国际细胞治疗协会(ISCT)制定的最低标准(定义),依然有不少研究的结果提示不同组织来源的MSC具有某些差异性,那么,究竟哪种来源的MSC更好呢?

2006年国际细胞治疗协会提出用表面抗原来定义人类 MSC
我们以临床上最为三种常见的:骨髓间充质干细胞(BM-MSC)、脂肪间充质干细胞(AT-MSC)和新生围产组织MSC(主要来源于脐带(UC-MSC))为例,逐一对比它们的细胞形态、增殖能力,分化潜能、分泌组与免疫调节特性。
在干细胞的世界里,“个头大”并不是一件好事。
我们知道,MSC一般会呈现出特别的纺锤形态,但在经历多次细胞分裂后,这种经典形象便会慢慢瓦解,MSC会逐渐变得大而扁平。换而言之,“个头大”是MSC衰老的体现。
这一点也被体现在不同组织来源的MSC上,有研究发现,取自新生儿围产组织来源的MSC的细胞直径普遍偏小,AT-MSC次之,而伴随人体成长最久的BM-MSC最大。
而“体型差”带来的最直接影响就是MSC的增殖代谢能力。
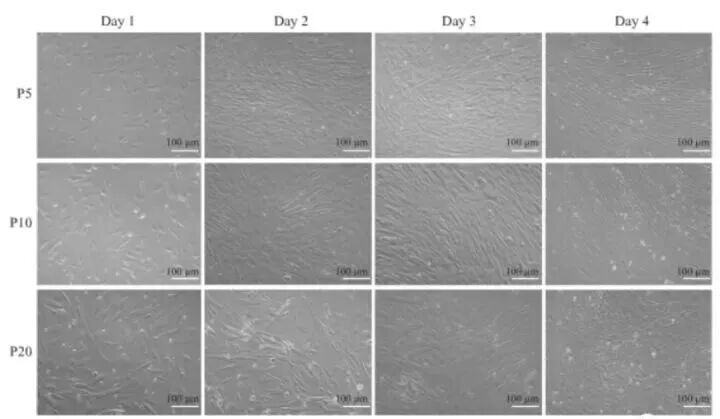
MSC衰老后胞体会增大,增殖能力减弱
通常情况下,一场研究中的MSC需求量是按百万级计算的,想要获得大量的MSC,势必要进行足够的体外培养扩增。
但就如同大多数细胞一样,MSC的增殖能力会随着衰老而减弱,直至停止分裂,如果MSC本身就不够“年轻”,那么即便最终数量达标,也会有一堆凋亡细胞在其中“浑水摸鱼”--这些细胞不但缺乏疗效,还有可能让身体产生毒性反应。
所以当前的临床研究更倾向于使用有“零岁细胞”之称的围产组织(如脐带、羊膜、胎盘等)MSC。
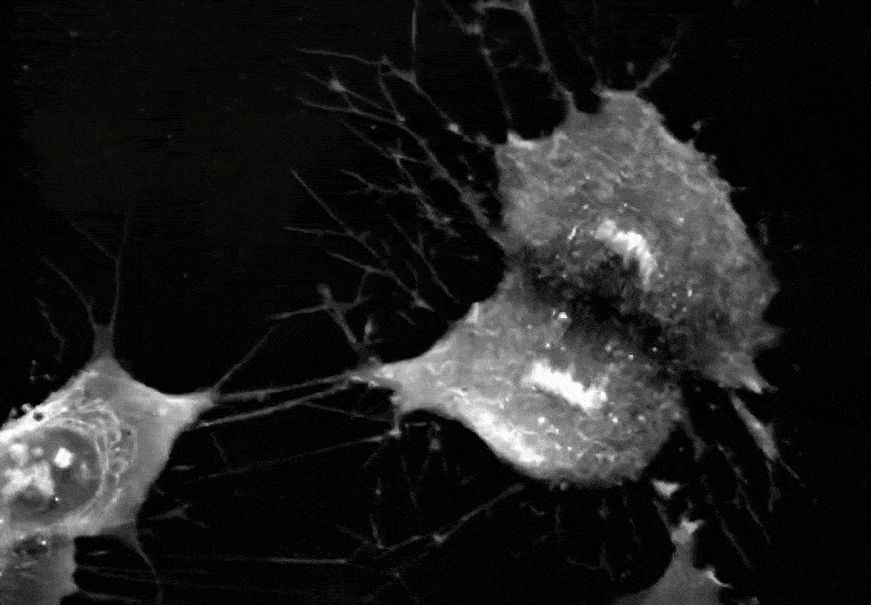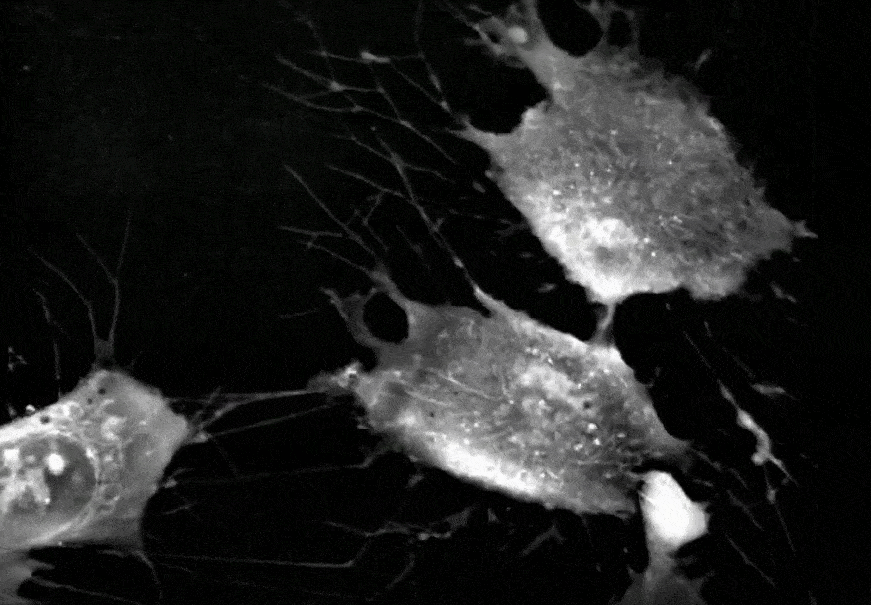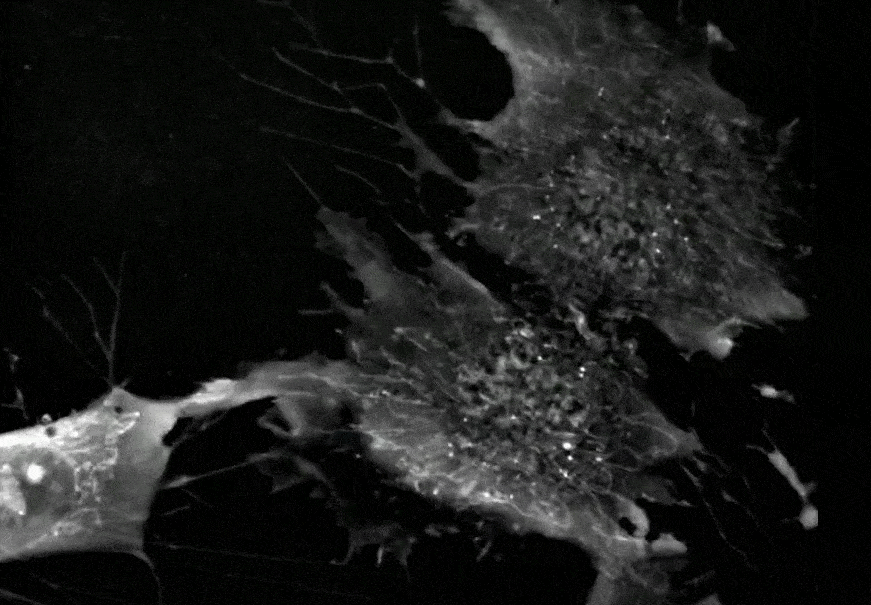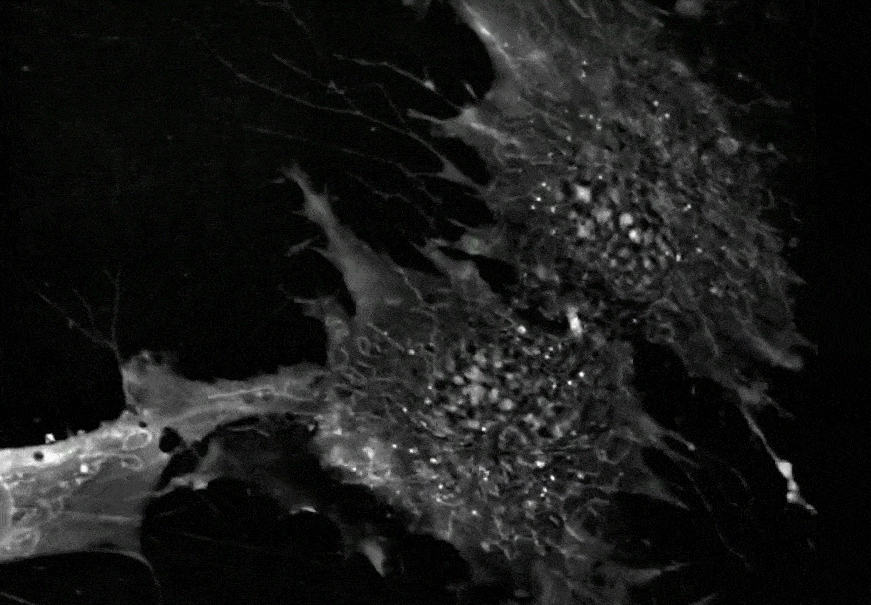
间充质干细胞正在进行分裂增殖
而对比另两种临床试验中的常客:BM-MSC与AT-MSC,则明显是后者优于前者。
当科学家尝试使用细胞倍增时间(DT)来描述细胞老化时,BM-MSC呈现出了较慢的增殖速率,它的DT时间通常需要40-60小时,甚至在传代至第6/7代时就已经出现衰老的迹象。
相比之下,AT-MSC的表现更好,DT时间数据缩短到20-45小时,且在传至第8代时也没有出现衰老迹象。值得注意的是:当研究者剥离其他因素,尝试对比由同一个供体提供的BM-MSC和AT-MSC时,这种差异也仍旧存在。
所以单就增殖能力而言,新生围产组织MSC>AT-MSC>BM-MSC。
PART 03
拥有体外向中胚层谱系分化的能力,可能是生物学上MSC最独特的特性之一。
与脐带、脐带血的来源相比,相同代数的骨髓来源MSC的克隆形成能力最弱。而克隆形成能力可作为评价MSC质量比较重要的指标。
细胞核型分析显示,骨髓MSC在培养至18代的时候出现了染色体异常和端粒酶缩短,而脐带MSC在培养至30代才出现染色体异常。不管MSC来源于何种组织,其均未发现在体外扩增多代数后出现基因突变具备肿瘤细胞的特性。
MSCs具有年龄特性,随着年龄增长,骨髓MSCs的数量和增殖能力出现明显下降。因此,很容易理解为胎儿组织(包括脐带、脐血、羊膜、羊水、胎盘等组织)来源的MSCs增殖能力强于成人组织(包括成年人骨髓、成年人脂肪等)。
有意思的是,性别也会影响到MSCs的大小和增殖能力。女性骨髓MSCs的细胞直径为20.9±0.8μm,其倍增时间约为3.3±1.9天,而男性骨髓MSCs的细胞直径为22±1.1μm,其倍增时间约为5.0±3.7天。

间充质干细胞具有分化成多种组织细胞的潜能
PART 04
医学上普遍认为,MSC的治疗作用主要是通过其分泌的可溶性因子和囊泡实现的。这些分泌体由小分子、趋化因子、细胞因子、生长因子以及外泌体等物质组成,微小的体积让他们能在人体内无障碍穿梭,甚至能无视令科学家们头疼的血脑屏障(BBB)发挥功效。
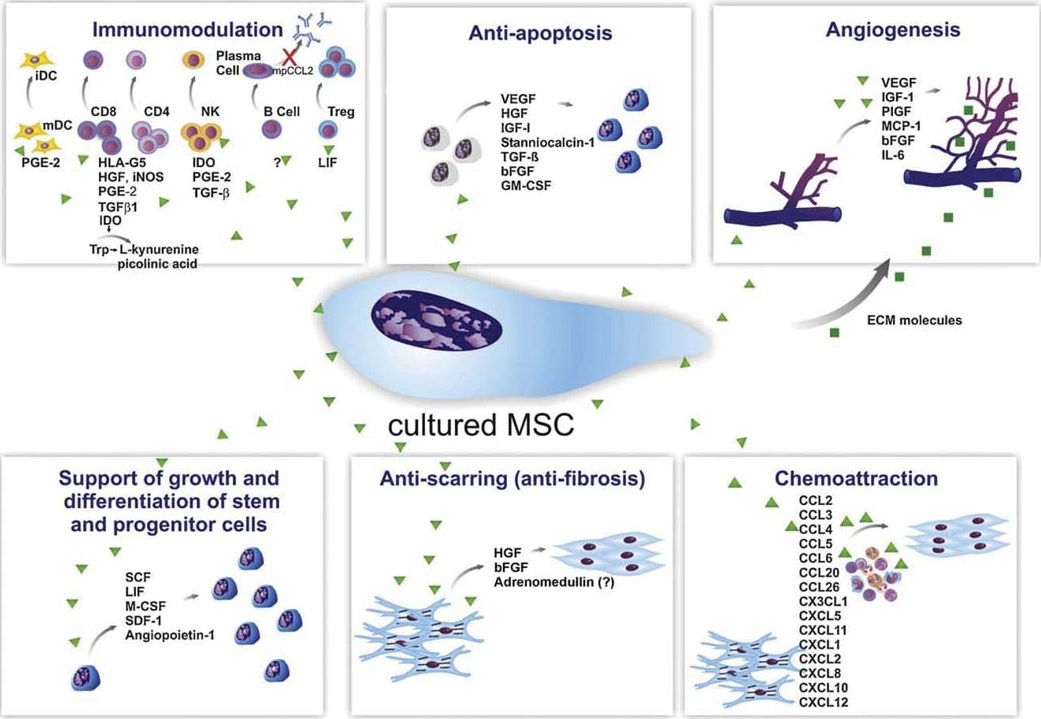
间充质干细胞的旁分泌作用会分泌多种细胞因子发挥作用
脐带:脐带MSC分泌的细胞因子(如G-CSF、GM-CSF、HGF、IL-6、IL-8、IL-11)远高于骨髓MSC,支持造血干细胞克隆形成的效果优于骨髓MSC。然而,也有研究显示其促进造血干细胞克隆形成的能力不如骨髓MSC。此外,脐带MSC高表达HGF而低表达VEGF。

骨髓:骨髓MSC促进造血干细胞克隆形成的能力存在争议,有研究认为优于脐带血和脐带来源,也有研究认为不如脐带血和脐带来源。骨髓MSC分泌的VEGF量较高,在促进血管新生方面有一定优势。此外,骨髓MSC表达较高的NGF。

间充质干细胞会分泌囊泡与可溶性因子
PART 05
在展开这个问题前,我们得先明白:“过强”或“太弱”的免疫力都有可能带来疾病,都有可能击垮我们的身体,而MSC刚好能成为一个维持平衡的“砝码”。
MSCs 能够调节包括T /B 淋巴细胞、自然杀伤细胞 (NK)、树突细胞巨噬细胞等多种免疫细胞的激活、增殖,它会产生细胞因子,创造出一个有利于损伤消退或组织修复的再生环境。
在这个基础之上,一些研究深入比较了UC-MSC、AT-MSC与 BM-MSC的免疫调节特性。
在共培养和跨孔混合淋巴细胞反应 (MLR)体外测定中。研究者发现UC-MSC 对 T 细胞增殖具有最显著的抑制作用,其次是AT-MSC和BM-MSC。UC-MSC的囊泡中还富含PDL1,可以增强MSC的免疫抑制作用,在对抗免疫介导疾病(如系统性红斑狼疮、银屑病、类风湿性关节炎等)中有显著效果。
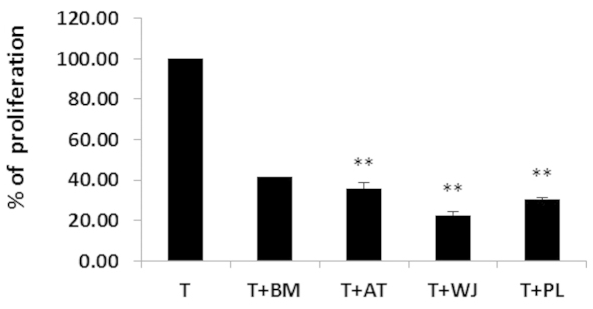
间充质干细胞抑制T细胞增殖,其中WJ指脐带沃顿氏胶,PL为胎盘间充质干细胞
综上所述,三种来源的MSC确实存在异质性(汇总信息参考下图),它们在一些疾病的治疗中也会显现差异,如胶质母细胞瘤、伤口愈合治疗中。
此外,UC-MSC的 HLA 抗原(HLA-DMA、HLA-DPB1 和 HLA-DR)表达最低,BM-MSC表达最高。这意味着在一般情况下,回输的UC-MSC可以在机体停留更长的时间,最不容易被免疫系统清除。
故从免疫调节潜力来说,UC-MSC>AT-MSC和BM-MSC,如果把停留机体的时间同步考量进去,BM-MSC就会是“吊车尾”了。
综上所述,三种来源的MSC确实存在异质性(汇总信息参考下图),它们在一些疾病的治疗中也会显现差异,如伤口愈合治疗等。
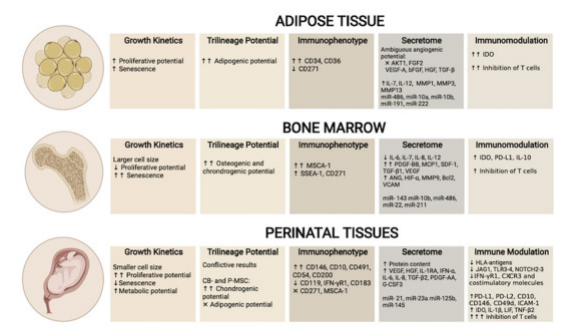
UC-MSC、AT-MSC及BM-MSC生物差异性对比,图中额外增加表面标志物对比
忽略其他外部因素,UC-MSC是临床中泛用性更强,生物学特性更优异的间充质干细胞。
获取来源也无需担心,我们在之前的文章中提到过,MSC支持异体使用。这些年同种异体MSC的研究数量也在逐年攀登,UC-MSC被视作是可大规模生成“药品”的有力候选者。
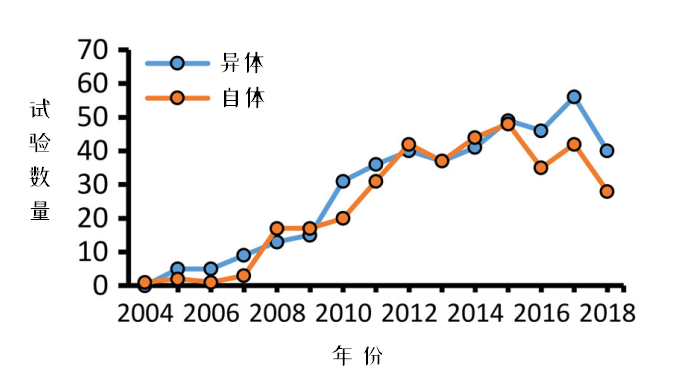
2004-2018年间充质干细胞临床试验趋势
总结
目前,MSC常见于3大组织来源:骨髓、脐带、脂肪。根据目前的研究结果,大致能得出一些结论:
1、MSC在组织中的含量(细胞丰度):脐带的含量最高,脂肪次之,骨髓含量极少;
2、MSC增殖能力:由于MSCs具有年龄特性,脐带来源的MSCs具有明显优势,脂肪和骨髓次之;
3、免疫调节能力:脐带和脂肪来源的MSCs优于骨髓MSCs;
4、分泌细胞因子谱:脐带MSCs分泌细胞生长因子的总量明显高于骨髓MSCs,但不同来源的分泌细胞因子谱有明显的特点;
5、来源获取方便及增殖能力等特性:能培养获得大量的MSCs足够满足临床治疗需要,使得脐带和脂肪最适合作为MSCs细胞治疗的组织来源。
需要注意的是,不同的实验室、不同的分离方法及不同的培养体系对MSC的实验研究结果产生影响,因此在实际应用中需要谨慎对待这些差异。同时,即使是相同来源的MSC,不同个体之间也可能会出现功能上的异质性。因此,在应用MSC进行细胞治疗时需要选择合适的组织来源和培养体系(培养基很重要),并注意供者年龄对细胞质量的影响。
LIFE SEEK写在最后
基于自身的特性,间充质干细胞被喻为干细胞中的“孙悟空”,成为了干细胞领域的宠儿。它不仅具有干细胞固有的增殖分化能力,还拥有强大的免疫调节功能。随着科学家们的深入发掘和控制利用,间充质干细胞将能广泛应用于更多疾病的临床治疗中。
以上内容均源于公开发表的文献、学术会议报道或媒体信息,仅供用户了解细胞行业资讯,内容不代表任何药品推广观点或用药建议,亦不能替代医生的独立专业判断,部分图片来自网络,侵删。
关于生命求索
作为国内实现「细胞技术+AI +临床服务+软硬件解决方案+人才培养」全链条赋能的平台型企业,生命求索依托深厚行业积淀的专家团队与自主创新技术体系,提供细胞产、学、研、用整体解决方案。

科研成果转化主要有:细胞智能方舱实验室、TIL细胞、免疫细胞、干细胞、外泌体等。
旗下大模型平台:LIFESEEK 生命求索--国内基于DeepSeek的细胞产业全链条AI大模型平台。
