同于糖尿病传统药物/胰岛素治疗,干细胞突破“症状控制”的局限,“修复”性治疗糖尿病,如同一支精密修复部队,直击糖尿病核心病理。
根据2025年4月国际糖尿病联盟官网发布的最新数据,截至2024年全球20–79岁糖尿病患者已达5.89亿,其中我国患者数量居首,约为1.48亿。预计到2050年,全球患者总数将增至8.53亿。
对于糖尿病患者而言,“控糖”是终身战役——每日监测血糖、按时注射胰岛素、严格控制饮食,却仍难逃并发症风险。但随着再生医学的突破,间充质干细胞(MSCs)正打破传统治疗的局限,从“控制血糖”转向“修复胰岛”,为糖友带来希望。
2025年10月,一项来自国际期刊《Tissue & Cell》的综述,对近年涉及“间充质干细胞(MSCs)治疗糖尿病”的临床证据进行了系统梳理——共纳入17篇系统综述与Meta分析,涵盖8000多名患者。

研究结果表明:MSCs治疗与血糖更平稳、胰岛素用量下降、代谢指标全面改善密切相关。在2型糖尿病(T2DM)人群中,这种改善尤为突出,呈现出“控糖更稳、波动更小、胰岛素依赖更轻”的趋势。
这篇综述给出了几组值得关注的数据:
HbA1c(糖化血红蛋白)平均下降约1.45个百分点,提示长期血糖水平显著改善;
日均胰岛素用量下降约2.05U/kg,部分患者对外源性胰岛素的依赖明显减少;
C-肽水平提升,意味着胰岛β细胞功能活性被“唤醒”;
2型糖尿病(T2DM)组改善更为一致,而在1型糖尿病(T1DM)中也观察到代谢平衡的积极变化;
不同来源MSCs效果存在差异,脐带与骨髓来源效果较优,脐血来源略逊。
干细胞如何重启“代谢稳态”?
不同于糖尿病传统药物/胰岛素治疗,干细胞突破“症状控制”的局限,“修复”性治疗糖尿病,如同一支精密修复部队,直击糖尿病核心病理:
护胰岛:外泌体携带miR-21等分子,抑制胰岛β细胞凋亡,维持胰岛素分泌功能;
调免疫:提升调节性T细胞(Tregs),抑制自身免疫攻击(T1D关键);
破抵抗:转化肝脏/脂肪中的巨噬细胞表型(M1→M2),改善胰岛素信号传导;
促新生:分泌血管内皮生长因子(VEGF),修复受损微血管网络。
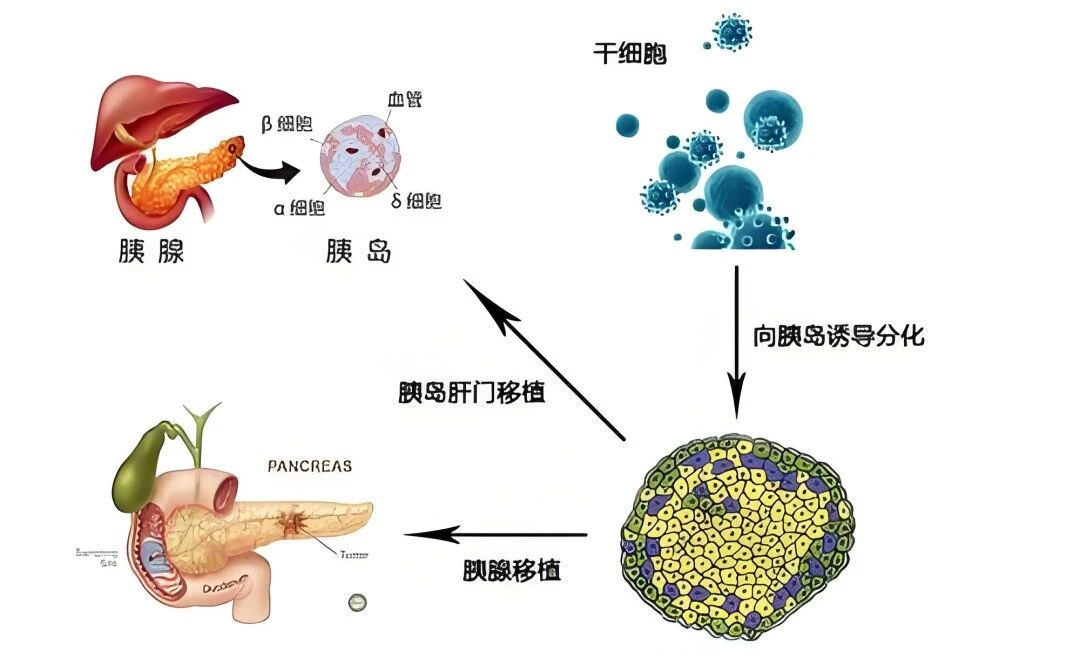
综合分析指出,以下患者应答率显著提升:
血糖波动大(日内波动>4.4mmol/L)的胰岛素依赖者;
合并代谢综合征(肥胖、脂肪肝、高血脂)的T2D患者;
残余β细胞功能>10%的早中期糖尿病患者;
规范治疗仍难以达标(HbA1c>8.5%)的耐药人群。
理念升级:从“控制指标”到“系统修复”
传统糖尿病治疗以“控制血糖指标”为核心,通过药物、胰岛素强制压低血糖,却无法阻止胰岛功能的持续衰退。而间充质干细胞的独特优势在于:
免疫调节:缓解糖尿病患者体内的慢性炎症,为胰岛细胞创造良好的修复环境;
组织修复:直接修复受损的胰岛β细胞,或分化为新的胰岛细胞,重建机体自身的控糖系统;
全身调理:改善患者的代谢紊乱,不仅修复胰岛,还能同步改善血脂、血压等相关代谢指标。
这种“系统修复”的治疗理念,标志着糖尿病治疗正从“被动控糖”向“主动修复”转变,而干细胞正是这场变革的核心力量。
血糖控制更加平稳,系统修复更为彻底——这正是干细胞技术为医学未来开启的全新可能。
以上内容均源于公开发表的文献、学术会议报道或媒体信息,仅供用户了解细胞行业资讯,内容不代表任何药品推广观点或用药建议,亦不能替代医生的独立专业判断,部分图片来自网络,侵删。
关于生命求索
作为国内实现「细胞技术+AI +临床服务+软硬件解决方案+人才培养」全链条赋能的平台型企业,生命求索依托深厚行业积淀的专家团队与自主创新技术体系,提供细胞产、学、研、用整体解决方案。

科研成果转化主要有:细胞智能方舱实验室、TIL细胞、免疫细胞、干细胞、外泌体等。
旗下大模型平台:LIFESEEK 生命求索--国内基于DeepSeek的细胞产业全链条AI大模型平台。
