慢性炎症可通过诱导基因突变、促进增殖和抵抗凋亡而成为肿瘤发生的驱动力。
清华大学医学院常智杰教授团队最新发文认为脐带间充质干细胞通过调节巨噬细胞改善炎症相关的肿瘤发生,该研究发表在《Stem Cell International》上。

慢性炎症是肿瘤发生的最重要的危险因素之一。慢性炎症可通过诱导基因突变、促进增殖和抵抗凋亡而成为肿瘤发生的驱动力。
在炎症条件下,包括T、B、NK和巨噬细胞在内的免疫细胞失调,所有这些细胞都分泌促炎因子,促进肿瘤生长。
间充质干细胞疗法为治疗多种炎症和自身免疫性疾病提供了很多令人信服的证据,具有潜在的抗炎和免疫调节作用,许多研究表明,间充质干细胞可有效缓解鼻炎,关节炎,结肠炎、系统性红斑狼疮肾炎,以及移植物抗宿主病。
其治疗炎症可能的机制是MSCs能够迁移到炎症部位,并调节免疫细胞。
MSCs抑制T细胞、B细胞和NK细胞的活化和增殖;抑制树突细胞成熟;促进调节性T细胞(Treg细胞)的生成;诱导巨噬细胞从促炎性M1表型向抗炎性M2表型分化;并通过分泌IL-10减少炎症,抑制炎症因子TNF-α的分泌α和IL-6减少炎症。
本研究旨在进行一项安全性评估,并评估人脐带间充质干细胞(HUC-MSCs)在肿瘤发生中的作用。
作者发现在20代内培养的脐带间充质干细胞在细胞增殖、细胞周期、细胞衰老、凋亡和标志物表达方面没有显著变化,无论有无炎症刺激,脐带间充质干细胞都不会在免疫缺陷或正常小鼠中形成任何肿瘤。
更为重要的是,作者观察到脐带间充质干细胞抑制了B16诱导的结肠癌模型中的肿瘤发生。
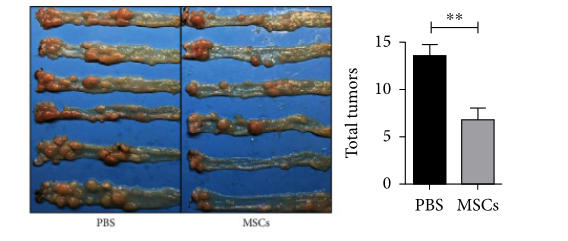
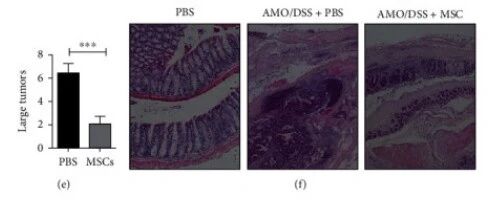
HUC-MSCs有效抑制肿瘤发生。(c) HUC-MSC注射降低了C57BL/6J小鼠的结肠肿瘤负荷(n= 5)。(d,e)PBS和HUC-MSC组中的肿瘤数目。(f)结肠的苏木精-伊红染色。静脉注射HUC骨髓间充质干细胞促进组织学改善。
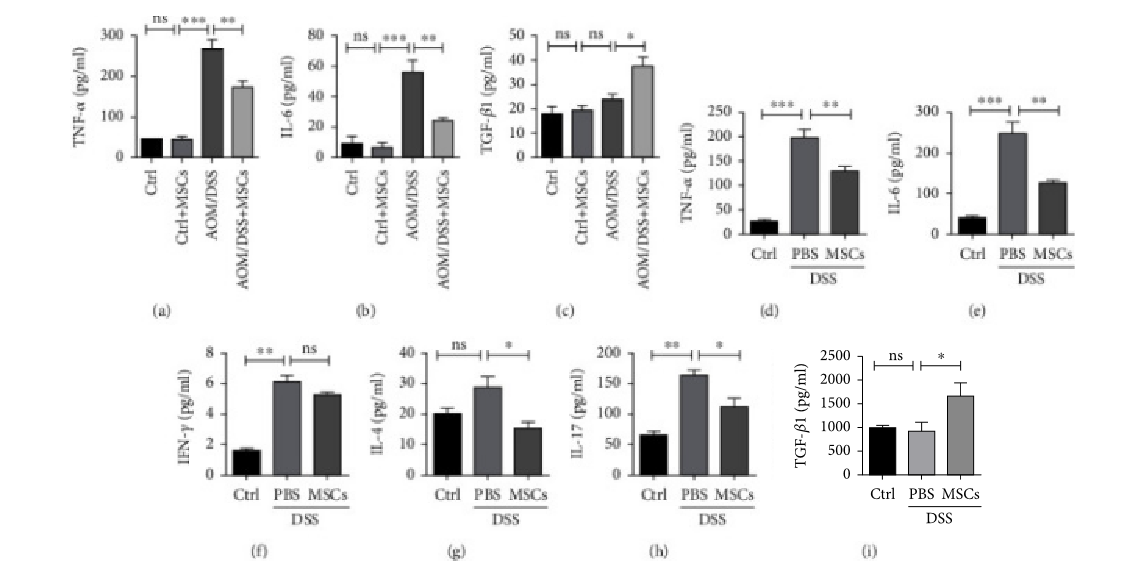
HUC-MSCs调节结肠炎和结肠炎相关结肠癌中炎症细胞因子的产生
在这篇报道中,作者研究了间充质干细胞的特性,发现脐带间充质干细胞显著抑制了B16细胞和结肠炎诱导的结肠癌模型中的肿瘤发生。该结果提供了强有力的证据,表明间充质干细胞可能具有抑制肿瘤发生的功能。
这增加了我们对基于MSC的疗法的应用的信心,不仅在炎症疾病中,而且在癌症中,特别是炎症相关的癌症中。
HUC-MSCs在裸鼠中对B16细胞衍生的肿瘤的抑制作用令人惊讶,因为裸鼠缺乏T和B细胞。然而,裸鼠保留了巨噬细胞,巨噬细胞也在肿瘤发生中起重要作用。因此,为解释巨噬细胞的调节是否能有效抑制肿瘤发生,作者采用了AOM/DSS诱导的结肠癌模型,并观察到HUC-MSCs显著抑制了结肠癌的发生。基于这些结果,作者提出HUC-MSCs通过调节巨噬细胞来抑制肿瘤的发生。
巨噬细胞如何影响肿瘤发生仍不清楚。
在这项研究中,研究者提供了HUC-MSCs抑制巨噬细胞活化的证据。HUC-间充质干细胞能够引导巨噬细胞从M1分化成M2,M2巨噬细胞被认为是肿瘤的抑制剂。然而也有研究认为肿瘤浸润的巨噬细胞在被培养成M2形式后,具有促进肿瘤生长的潜在能力。
M2巨噬细胞的这些有争议的作用可能意味着M2巨噬细胞有不同的亚群。最近的研究揭示有不同亚群的M2巨噬细胞,包括M2a、2b、2c和2d。作者观察到M2巨噬细胞分泌的IL-10在HUC-MSC治疗后显著增加。来自人间充质干细胞的外泌体通过极化M2b巨噬细胞和调节IL-10分泌来减少小鼠结肠炎症。因此,值得继续深入研究M2巨噬细胞,特别是M2b巨噬细胞的这些不同亚群的。
总之,研究发现HUC-MSCs通过减少炎性细胞因子的产生和重新平衡免疫细胞群,特别是巨噬细胞,减轻了小鼠结肠炎症和肿瘤发生。因此,HUC-MSC疗法有望成为结肠炎相关性结肠癌患者的一种安全有效的治疗方法。
以上内容均源于公开发表的文献、学术会议报道或媒体信息,仅供用户了解细胞行业资讯,内容不代表任何药品推广观点或用药建议,亦不能替代医生的独立专业判断,部分图片来自网络,侵删。
关于生命求索
作为国内实现「细胞技术+AI +临床服务+软硬件解决方案+人才培养」全链条赋能的平台型企业,生命求索依托深厚行业积淀的专家团队与自主创新技术体系,提供细胞产、学、研、用整体解决方案。

科研成果转化主要有:细胞智能方舱实验室、TIL细胞、免疫细胞、干细胞、外泌体等。
旗下大模型平台:LIFESEEK 生命求索--国内基于DeepSeek的细胞产业全链条AI大模型平台。
