这篇文章综述了代谢性细胞死亡(包括铁死亡、铜死亡和二硫化物死亡)在癌症治疗中的潜力。
在癌症治疗的漫长征途中,科学家们一直在寻找能够精准打击癌细胞的武器。近期,得克萨斯大学甘波谊、Albert C. Koong、Dadi Jiang等人以“Exploiting metabolic cell death for cancer therapy”为题在《Nature Reviews Cancer》杂志上发表的一篇综述文章为我们揭示了一个全新的视角——代谢性细胞死亡。这篇文章不仅深入探讨了代谢性细胞死亡的分子机制,还为我们展示了如何利用这些机制来开发创新的癌症治疗策略。今天,就让我们一起走进这篇文章,探索代谢性细胞死亡在癌症治疗中的潜力。

【主要内容】
1.从凋亡到代谢性细胞死亡
传统的细胞死亡研究主要集中在凋亡、坏死和焦亡等主动细胞死亡方式上。这些过程通常由特定的信号通路和分子效应器介导,确保受损、多余或癌变细胞的精确清除。然而,近年来,科学家们发现,细胞代谢的紊乱同样可以触发一种非凋亡性的细胞死亡,这种死亡方式被称为代谢性细胞死亡。代谢性细胞死亡包括铁死亡(ferroptosis)、铜死亡(cuproptosis)和二硫化物死亡(disulfidptosis)等多种形式。这些死亡方式各有其独特的分子机制和调控网络,而癌细胞由于其代谢特征与正常细胞不同,对这些代谢性细胞死亡方式表现出独特的敏感性。
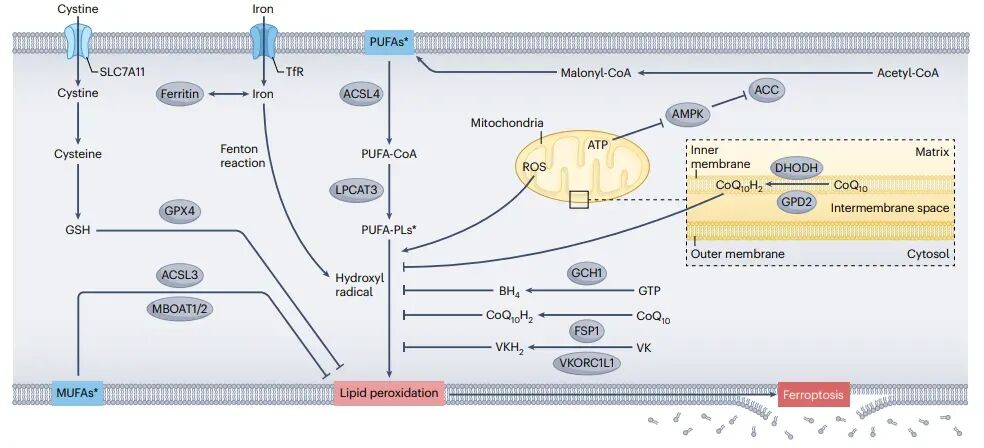
铁死亡的分子机制
2.铁死亡:脂质过氧化的“铁证”
铁死亡是一种铁依赖的细胞死亡形式,最早在2012年被Stockwell团队发现。与凋亡不同,铁死亡并不表现出染色质凝聚或caspase-3激活等典型细胞死亡标志,而是以线粒体收缩和线粒体嵴减少为特征。这种细胞死亡方式可以通过铁螯合剂或脂溶性抗氧化剂有效预防,而其他细胞死亡途径的抑制剂则无能为力。铁死亡的诱导涉及铁代谢、脂质过氧化和线粒体代谢输入的相互作用。多不饱和脂肪酸(PUFAs)是细胞膜的重要组成部分,它们在维持膜的流动性和完整性方面发挥着关键作用。然而,由于其双烯丙基键的存在,PUFAs也增加了细胞对脂质过氧化的敏感性。在铁死亡过程中,铁离子通过芬顿反应催化羟基自由基的形成,引发PUFAs的过氧化,最终导致细胞死亡。线粒体在铁死亡中也扮演着重要角色。线粒体通过电子传递链产生活性氧(ROS),并调节能量稳态,从而影响铁死亡的进程。能量耗竭会激活AMPK,抑制脂肪酸合成,进而减少PUFAs的合成,抑制铁死亡。相反,充足的ATP水平会抑制AMPK,促进PUFAs的合成,增强铁死亡。
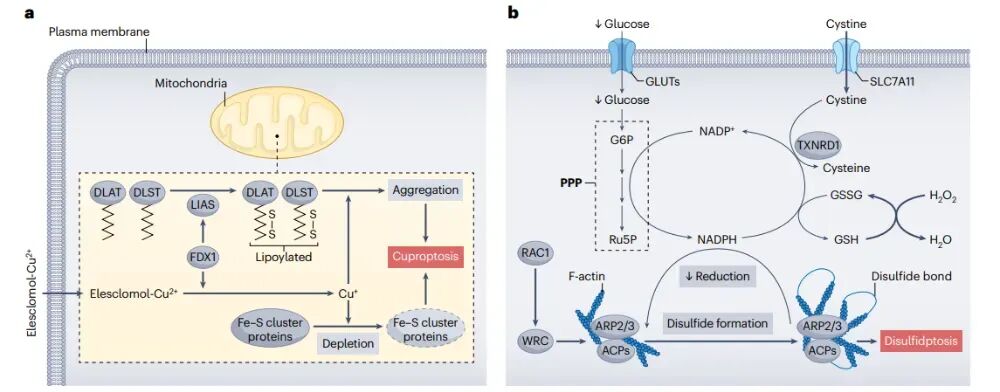
铜诱导细胞凋亡和二硫键断裂的分子机制
3.铜死亡:铜离子的“致命诱惑”
铜是细胞内许多重要生物过程所必需的金属元素,但当细胞内铜离子水平超过一定阈值时,就会引发一种名为铜死亡的细胞死亡方式。铜死亡的特征是铜离子与线粒体蛋白的结合,导致蛋白的脂酰化和聚集。铜死亡的分子机制涉及铜离子的细胞内运输、线粒体内的还原以及与特定蛋白的结合。铜离子通过铜离子载体(如elesclomol)进入细胞后,在线粒体内被还原为更具毒性的Cu+。Cu+会耗竭铁硫簇蛋白,并与脂酰化蛋白(如DLAT和DLST)结合,引发蛋白聚集和蛋白毒性应激,最终导致细胞死亡。铜死亡的发现为癌症治疗提供了新的思路。一些铜离子载体,如elesclomol和disulfiram,已被证明对多种癌细胞具有选择性的毒性。这些药物通过增加细胞内铜离子水平来诱导铜死亡,可能成为一种有潜力的癌症治疗策略。
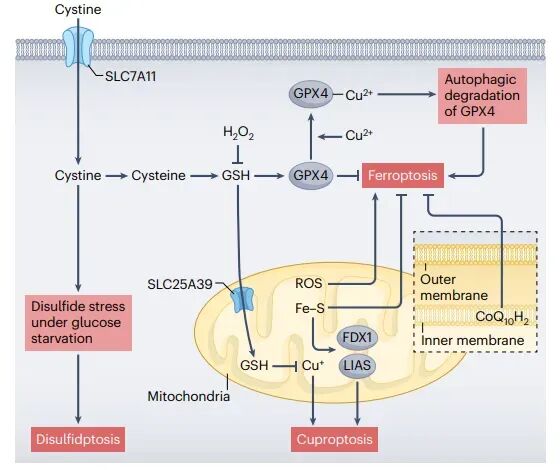
铁死亡、铜死亡和二硫键断裂死亡之间的相互影响
4.二硫化物死亡:葡萄糖剥夺的“致命打击”
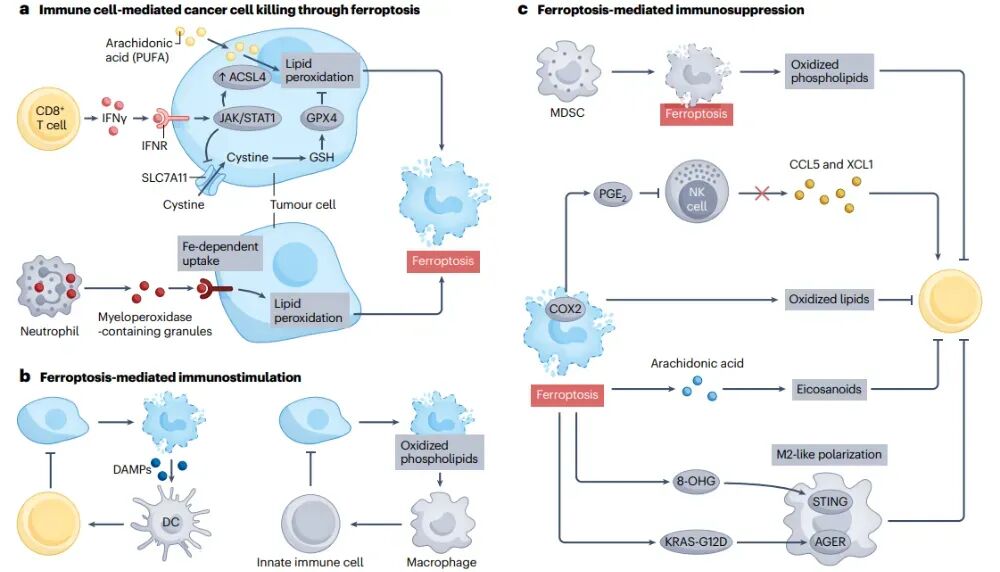
铁死亡在抗肿瘤免疫中的作用
5.代谢性细胞死亡的交叉对话:线粒体和谷胱甘肽的双重角色
代谢性细胞死亡并非孤立发生,铁死亡、铜死亡和二硫化物死亡之间存在着复杂的交叉对话。线粒体作为细胞能量代谢的核心,是铁死亡和铜死亡的关键交汇点。线粒体不仅通过调节代谢通量和ROS生成影响铁死亡,还通过铁硫簇组装和线粒体HMOX-1介导的血红素降解影响铁稳态。谷胱甘肽(GSH)在代谢性细胞死亡中也扮演着双重角色。GSH是GPX4的必要辅因子,能够抑制铁死亡。同时,GSH还能螯合铜离子,防止铜离子的过度积累,从而抑制铜死亡。此外,GSH代谢与二硫化物死亡也有密切联系,GSH的耗竭会加剧二硫化物应激,促进二硫化物死亡。
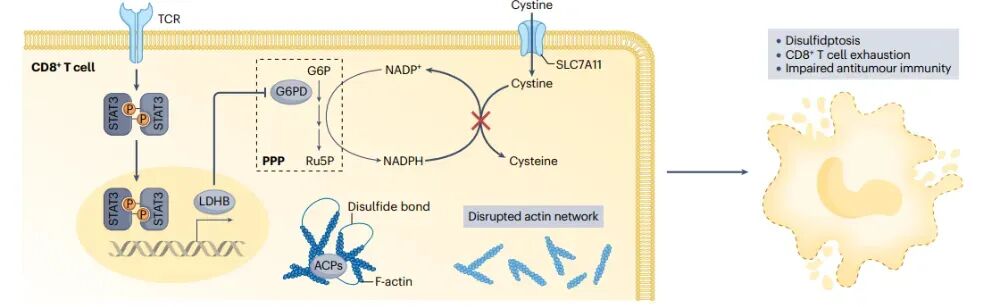
二硫键断裂在抗肿瘤免疫中的作用
6.代谢性细胞死亡在癌症治疗中的应用前景
代谢性细胞死亡的发现为癌症治疗带来了新的希望。通过靶向铁死亡、铜死亡和二硫化物死亡,我们可以开发出一系列创新的癌症治疗策略。例如,铁死亡诱导剂(如erastin和RSL3)已被证明对多种癌细胞系具有显著的抗肿瘤效果。铜死亡诱导剂(如elesclomol和disulfiram)也在多种癌症模型中显示出良好的治疗潜力。二硫化物死亡诱导剂(如GLUT1抑制剂BAY-876和TXNRD1抑制剂)则为高表达SLC7A11的癌细胞提供了新的治疗方向。
【全文总结】这篇文章综述了代谢性细胞死亡(包括铁死亡、铜死亡和二硫化物死亡)在癌症治疗中的潜力。文章详细探讨了这些代谢性细胞死亡的分子机制、调控网络以及它们之间的相互作用,并讨论了如何利用这些机制来开发创新的癌症治疗策略。尽管代谢性细胞死亡为癌症治疗带来了新的希望,但肿瘤内异质性、治疗窗口狭窄、缺乏可靠生物标志物和非特异性毒性等问题仍需解决。
以上内容均源于公开发表的文献、学术会议报道或媒体信息,仅供用户了解细胞行业资讯,内容不代表任何药品推广观点或用药建议,亦不能替代医生的独立专业判断,部分图片来自网络,侵删。
关于生命求索
作为国内实现「细胞技术+AI +临床服务+软硬件解决方案+人才培养」全链条赋能的平台型企业,生命求索依托深厚行业积淀的专家团队与自主创新技术体系,提供细胞产、学、研、用整体解决方案。

科研成果转化主要有:细胞智能方舱实验室、TIL细胞、免疫细胞、干细胞、外泌体等。
旗下大模型平台:LIFESEEK 生命求索--国内基于DeepSeek的细胞产业全链条AI大模型平台。
