我们期待TIL等免疫细胞疗法能够治愈更多的患者,让患者得到高疗效,高质量的治疗体验。
随着免疫治疗领域的快速发展,肿瘤浸润淋巴细胞(TIL)疗法作为一项创新性治疗手段,在肿瘤治疗中展现出显著的潜力。TIL疗法利用患者自身的免疫细胞——特别是那些能够识别并攻击肿瘤细胞的T细胞——来对抗癌症。近年来,TIL疗法在多种实体瘤治疗中取得了令人鼓舞的成果,成为继CAR-T细胞疗法之后又一重要的、具有独特优势的免疫治疗方向。
为了帮助读者快速掌握TIL疗法的核心概念和技术要点,《中国肿瘤整合诊治技术指南(CACA)—免疫治疗》提供了详尽的专业指导。该指南不仅涵盖了TIL疗法的基础原理、制备流程、临床应用,还深入探讨了其安全性管理及未来的发展趋势。基于此,特别整理了这些关键信息,旨在便于广大医疗工作者和患者更好地理解TIL疗法的应用价值及其实施细节,促进这一前沿疗法的普及与应用。
肿瘤浸润淋巴细胞疗法(tumor infiltrating lymphocyte,TIL) 与淋巴因子激活的杀伤细胞疗法(LAK)疗法几乎同一时期诞生,1986年Steven A. Rosenberg从小鼠肿瘤中分离出浸润淋巴细胞,在体外扩增后输入荷瘤小鼠,发现小鼠肿瘤生长被明显抑制。使用的TIL是从肿瘤组织中分离的淋巴细胞,成分不单一,主要是T细胞。由于TIL浸润到肿瘤组织内部,多数已具备识别肿瘤抗原并杀伤瘤细胞的能力,将其在体外扩增后回输患者就可产生更强控瘤效果。相对LAK疗法,TIL的有效性和安全性更强。
LAK疗法是最早用于治疗肿瘤的免疫细胞疗法,由Steven A. Rosenberg等于20世纪80年代提出,即在体外使用细胞因子IL-2对外周血淋巴细胞进行诱导扩增,产生对肿瘤具有杀伤能力的细胞。LAK细胞治疗会使用大剂量IL-2,故致不良反应,由于疗效欠佳且不良反应严重,LAK疗法目前已被淘汰。
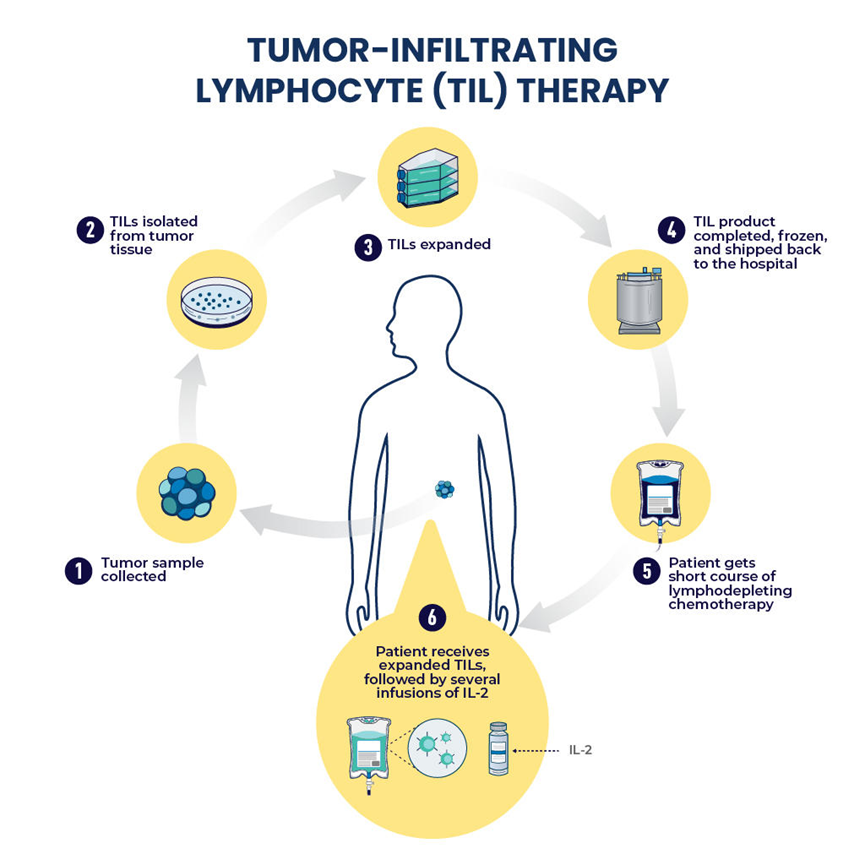
TIL细胞疗法的治疗过程
LIFE SEEKTIL疗法的原理
TIL过继治疗是一种高度个体化的肿瘤免疫疗法。通过活检或手术从肿瘤部位分离并筛选获取淋巴细胞,在体外用白细胞介素-2 (IL-2) 刺激并大量扩增,然后回输到患者体内。自从Rosenberg成功地将TIL疗法用于转移性黑色素瘤患者,显示出令人印象深刻的临床效果后,一系列临床试验相继开展。
该疗法大致分四个步骤 :
①患者进行手术活检,获得足够肿瘤组织后从中提取和分离TIL细胞;
②对分离出的TIL细胞加入IL2在体外对其进行扩增培养,得到一定细胞数量后用患者自身瘤细胞与其共培养,筛选出对瘤细胞有反应的TIL细胞;
③将筛选得到的肿瘤特异性TIL细胞进一步扩增培养;
④回输患者体内。
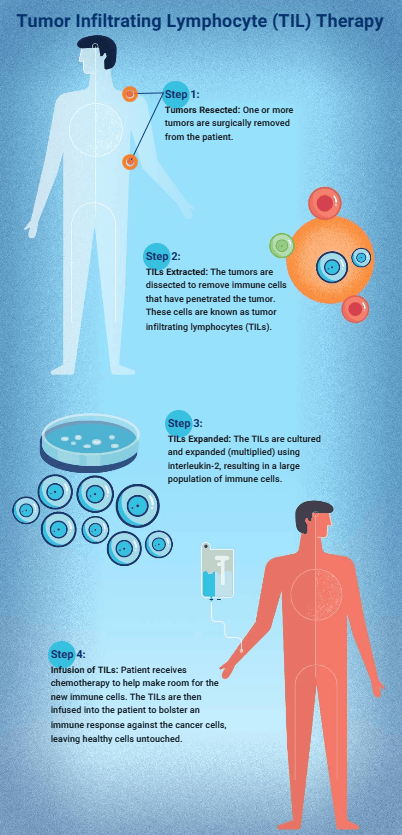
LIFE SEEKTIL疗法优势和局限性
多年的临床研究表明,TIL疗法在治疗实体瘤的优势更大。实体瘤瘤细胞异质性强,单一肿瘤抗原靶点不能覆盖所有瘤细胞,所以靶向单一肿瘤抗原的细胞疗法(如CAR-T) 治疗实体瘤效果不佳。而TIL疗法中使用的细胞是对肿瘤具有反应性的一群异质性细胞,这些细胞靶向的抗原各不相同,能识别患者肿瘤组织中一系列肿瘤抗原,所以TIL疗法在面对异质性较强的实体瘤时能更高效杀伤肿瘤。
但TIL疗法在临床应用中也有一些局限性。首先,临床上一些患者的肿瘤组织无法分离出足够数量的TIL细胞以供体外筛选和扩增培养;其次,部分TIL细胞输入体内后会发生功能耗竭导致疗效变差;此外,TIL疗法的制备工艺较复杂且成本较高,在体外对TIL细胞进行筛选和扩增的过程耗时较长。
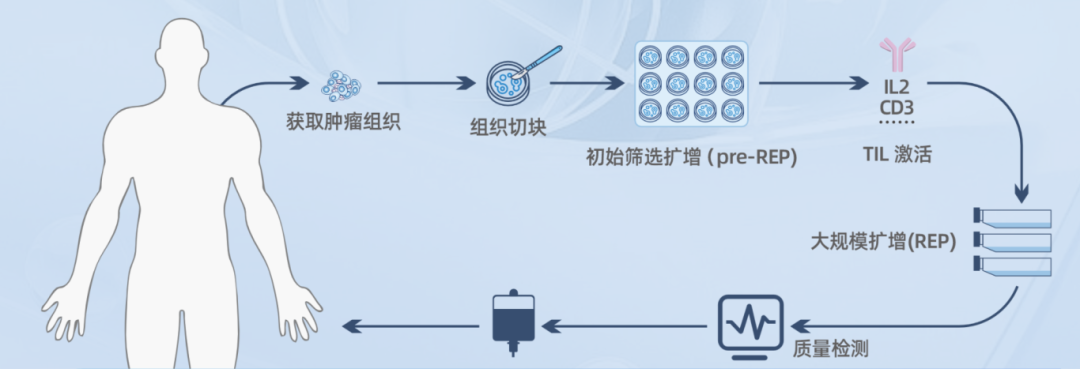
LIFE SEEKTIL细胞的制备流程和质控
TIL 细胞制备的条件与设施TIL细胞需在GMP生产条件的洁净室中制备,整体洁净室还应包括样本接收区、样本储存区、质控区和检测区等,可参考CAR-T细胞的相应部分。
1.1 试剂及耗材要求
TIL细胞制备过程中涉及试剂包括:淋巴细胞分离液、CD3单抗、无血清培养基、IL-2、抗生素、细胞冻存液等。制备所需耗材包括无菌细胞培养瓶、细胞培养袋、离心管、移液管等。制备过程中使用试剂及耗材应符合相应质量标准,明确记录其来源信息、批号、质量检测报告。
1.2 TIL细胞制备流程
主要包括:快速扩增前阶段(pre-rapid expansion protocol, pre-REP), 快速扩增阶段(rapid expansion protocol,REP),TIL细胞质控及放行,TIL细胞回输等,全程一般需4~8周。
1.3 快速扩增前阶段
包括仅用IL-2从肿瘤片段中建立、培养(小规模)和冷冻保存TIL。手术或活检过程中获得肿瘤标本置于无血清培养液中(含庆大霉素和两性霉素B),室温下运输,至实验室后立即开始TIL培养或将其放置在4℃冰箱中,准备好培养条件(24 h内)开始培养。
1.4 快速扩增阶段
冻存TILs解冻并恢复1~3 d后用于REP。理想情况下,解冻至少6×107细胞用于REP。滋养细胞采集和照射。滋养细胞是通过汇集来自至少3个到6个不同异基因健康供体外周血来源的单个核细胞制备。人工抗原提呈细胞也可用来替代滋养细胞。TIL细胞培养14 d左右,根据所需细胞数进行收获及回输。经检测并经第三方验证达到放行标准,便可用于患者输注。
TIL细胞质控
细胞输注给病人前,须证明产品无菌性。TIL细胞制备过程共需进行3次安全性检测。第一次是在快速扩增前阶段培养的第一周,即第4d至第7d间,抽取适量样本行细菌真菌检测。第二次是在扩大培养TIL之前,即冻存或直接进行REP之前,需对细胞进行一系列标准质控检测,包括细菌真菌检测、内毒素检测、支原体检测等检测项目。第三次是在回输制备当天对细胞进行质控检测,其中回输前细菌真菌检测必须在最后一次操作后细胞采集回输前进行。其他检测标准参照前述CAR-T细胞的制备流程和质控。
TIL细胞放行
根据cGMP标准规定,需对制备过程中每一步骤进行质控并提供详细、规范TIL细胞终产品的放行规则,包括细胞活力、纯度、安全性和效力检测报告。我国多家中心目前对TIL细胞放行规则无统一标准,参考CAR-T细胞放行规则。
TIL细胞的回输及运输
TIL细胞回输当天,检测细胞活率,安全性,记录输入细胞量和回输日期。根据临床试验方案,有些TIL细胞制备完成后需低温储存。将细胞洗涤并浓缩后,将其等分至适当剂量后加入冷冻保护剂保存。细胞冻存常用含异丙醇的冻存盒行梯度缓慢降温或可控制冷冻速率的冷冻器。冷冻后再将细胞转移至液氮相中保存。液氮罐由专人负责,并对患者信息及其TIL细胞的信息做完善登记。运输时,需仔细核对细胞标签内容,填写回输发放记录。低温储存的TIL细胞制剂需在液氮相中运输;未经冻存的TIL细胞制剂置于装有冰袋的医疗转运箱(箱内温度为2~8℃) 中运输。运输人员应严格填写交接记录表,并在运输过程中严禁剧烈振荡及安检辐照。
LIFE SEEKTIL疗法在实体瘤中的应用
最早的TIL疗法临床试验是在1988年,Steven A. Rosenberg用TIL疗法对20例转移性黑色素瘤患者进行治疗,最终60%患者达到客观缓解。2011年,继之对转移性黑色素瘤的一项临床研究显示,在接受自体TIL回输和IL-2联合治疗后,93名患者有20名肿瘤完全缓解,而且其中19例在治疗后3 年依然保持肿瘤完全消退状态。除黑色素瘤外,后续多项临床试验结果逐渐证实,TIL疗法在结直肠癌、非小细胞肺癌(NSCLC)、转移性乳腺癌和转移性胆管癌中均展现出强大疗效。2019年,Iovance开发的TIL产品LN-145治疗27例晚期宫颈癌,获44%客观反应率和89%疾病控制率。同年6月,FDA授予LN-145治疗宫颈癌为突破性疗法的称号,这是细胞疗法治疗实体瘤的巨大突破。
目前,TIL治疗肿瘤类型主要是恶性黑色素瘤,其次是NSCLC、卵巢癌和头颈癌。转移性黑色素瘤和晚期宫颈癌显示较好临床疗效,NSCLC、结直肠癌和乳腺癌中也显示初步疗效。使用低剂量(low dose,LD) 或中剂量IL-2,ORR可超过30%,但大多数临床试验仍采用高剂量(high dose,HD) IL-2。HD IL-2可维持TIL生长和活性,但可引起全身毒性,临床需要密切监测和护理。HD IL-2还可促进抑制TIL控瘤反应调节性T细胞的产生,从而限制TIL在临床广泛应用。此外,TIL在体内不持久和肿瘤微环境中严重的免疫抑制也是影响TIL疗效原因。
TIL治疗恶性黑色素瘤
自从Rosenberg等成功将TIL疗法应用于转移性恶性黑色素瘤患者后,一系列临床试验相继开展。Dafni等报道,1988年至2016年接受TIL与IL-2联合治疗的晚期皮肤黑色素瘤患者ORR为41%,CR为12%。此外,接受HD IL-2方案患者ORR和CRR分别为43% 和14%,而LD IL-2组的ORR和CRR分别为35%和7%。该分析不包括葡萄膜黑色素瘤患者。但2017年首次报道TIL疗法用于罕见和难治性葡萄膜黑色素瘤患者,接受TIL和HD IL-2患者CR和PR分别为4.5% 和31.8%。2021年,对免疫检查点抑制剂(immune checkpoint inhibitors,ICI) 治疗后进展的晚期黑色素瘤患者进行TIL治疗的Ⅱ期临床试验表明,患者平均过继性回输TIL细胞数量为2.73×1010,疾病控制率为80%,ORR为36%,CR为3%,PR为33%。目前,TIL治疗主要作为二线治疗,恶性黑色素瘤仍是大多数临床试验的主要肿瘤类型。
1.1 TIL治疗恶性黑色素瘤预处理方案
TIL输注前行淋巴细胞清除是TIL治疗重要环节。淋巴细胞预处理方案能抑制CD4+ CD25+ 调节性T细胞(regulatory T cell,Treg) 活性;清除宿主淋巴细胞后可减少与转移T细胞竞争稳态细胞因子;淋巴细胞清除可为输液产品提供“物理空间”。常用预处理方案有环磷酰胺+氟达拉滨,氟达拉滨+放疗或环磷酰胺+氟达拉滨+放疗。
1.2 IL-2在TIL中的作用
单剂量IL-2分别于1992年和1998年获美国FDA批准,用于治疗转移性黑色素瘤和转移性肾细胞癌。对采用一线、二线治疗方法失败的转移性黑色素瘤患者,IL-2与TIL联合治疗,可改善TIL生长和活性,从而提高临床反应率。一项Ⅰ期试验评估15例转移性黑色素瘤患者不同IL-2剂量(0~720000 IU/kg) 对TIL控瘤作用。给予淋巴细胞清除及TIL回输时,LD IL-2(72000 IU/kg,i.v.,每8 h一次;共15次剂量)或HD IL-2(720000 IU/kg,i.v.,每8 h一次;12次剂量) 组患者瘤体减小,未接受IL-2治疗者未见这种疗效。Herlev等在转移性黑色素瘤患者进行淋巴细胞清除和TIL输注后皮下LD IL-2注射治疗(2 MIU,共14 d),整体有效率为33% (2/6)。另一项Ⅰ/Ⅱ期研究,对25例转移性黑色素瘤进行标准淋巴细胞清除化疗和TIL输注,然后以递减方式连续5 d输注IL-2(6、12和24 h以18 MIU/m2;24 h后以4.5 MIU/m2的速度持续3 d),ORR为42%。研究表明,降低IL-2剂量可能不会对临床结果产生负面影响。但到目前为止,IL-2输注次数与临床反应间尚无明确的相关性。因此,在以后的临床治疗中应重新考虑HD IL-2联合TIL输注的作用。
TIL治疗其他实体瘤
目前,TIL治疗的肿瘤类型主要是恶性黑色素瘤,其次是NSCLC、卵巢癌和头颈癌。转移性黑色素瘤和晚期宫颈癌中显示出较好临床疗效,NSCLC、结直肠癌和乳腺癌中也显示初步疗效。由于肿瘤抗原突变的异质性,TIL细胞对实体瘤产生应答有所不同。与恶性黑色素瘤的TIL相比,其他肿瘤TIL的反应性较弱且功能较低。目前,美国NIH正在针对患有各种转移性疾病(消化道肿瘤,乳腺癌,尿路上皮癌,卵巢癌和子宫内膜癌) 患者进行“篮子”式临床Ⅱ期研究,为TIL临床治疗提供有效依据(NCT01174121)。
TIL与其他疗法的联合应用
3.1 TIL与ICI联合
TIL联合ICI的疗法在最近一些试验中显示初步疗效。免疫检查点受体(如CTLA-4和PD-1/PD-L1) 表达于T 细胞表面,是免疫系统自我保护机制。肿瘤患者中,效应T细胞上CTLA-4和PD-1分子被上调,并分别与抗原呈递细胞或瘤细胞的B7-1/B7-2和PD-L1结合,从而导致T细胞功能受抑。此外,T细胞长期接触肿瘤抗原后,CD8+ T细胞会出现凋亡或进入异常分化状态,抑制性受体会高表达,使CD8+ T细胞对特异性肿瘤抗原几乎无反应,此时可用检查点抑制剂改善CD8+ T细胞活性。因此,为增加TIL肿瘤反应性,可在TIL初始培养阶段及在TIL输注后联合ICI治疗。
3.2 TIL与BRAF抑制剂联合
BRAF基因在细胞生长和分化中起重要作用。大部分肿瘤患者会发生BRAF突变,激活的BRAF突变(主要是V600E)可诱导免疫逃逸,使机体免疫“迟钝”,并获得逃避T细胞免疫反应的能力。BRAF抑制剂威罗非尼可降低相关免疫抑制信号,减少免疫抑制细胞,增强黑色素瘤抗原表达,促进淋巴细胞浸润和特异性T细胞增殖。威罗非尼治疗BRAF (V600E) 突变黑色素瘤的ORR高达50%,改善无进展生存率和总生存率,但BRAF抑制剂的临床作用持续时间短。最近在一项临床试验显示,接受TIL、HD IL-2和威罗非尼联合治疗11名转移性黑色素瘤有7名出现有效应答,其中2名患者达完全缓解。
3.3 TIL与其他疗法的联合
树突状细胞(dendritic cell,DC) 是人体抗原递呈能力最强的细胞,DC治疗通过采用病人自体单核细胞在体外培养诱导生成DC,然后负载相应肿瘤抗原,制成负载肿瘤抗原的DC,再将这些DC注入体内刺激体内的肿瘤杀伤性淋巴细胞增殖,发挥长期肿瘤监视作用和肿瘤杀伤作用,达到控灭肿瘤的目的。DC疫苗可和TIL治疗联合,激活和增加TIL数量,目前DC与TIL联合治疗的临床试验正在进行。溶瘤病毒通过使TIL分泌细胞因子,从而提高TIL的控瘤作用,TIL疗法与溶瘤病毒联合治疗也正在探索。一项TIL疗法联合腺病毒治疗转移性黑色素瘤临床试验表明,13例患者有5例达到客观缓解,其中3例完全缓解。
LIFE SEEK
写在最后
2024年2月,美国国食品药品监督管理局(FDA)加速批准全球首款TIL细胞疗法(lifileucel)上市,用于治疗晚期黑色素瘤,开启了TIL细胞疗法治疗实体瘤的“生命之钥”。
TIL细胞疗法作为一种高度个体化的肿瘤免疫疗法,利用患者自身的免疫细胞,针对特定的肿瘤进行治疗,减少了治疗不适应的风险,同时在攻击肿瘤细胞的同时,对正常细胞的损伤相对较小,减轻了患者的副作用和不良反应。我们期待TIL等免疫细胞疗法能够治愈更多的患者,让患者得到高疗效,高质量的治疗体验。
以上内容均源于公开发表的文献、学术会议报道或媒体信息,仅供用户了解细胞行业资讯,内容不代表任何药品推广观点或用药建议,亦不能替代医生的独立专业判断,部分图片来自网络,侵删。
关于生命求索
作为国内实现「细胞技术+AI +临床服务+软硬件解决方案+人才培养」全链条赋能的平台型企业,生命求索依托深厚行业积淀的专家团队与自主创新技术体系,提供细胞产、学、研、用整体解决方案。

科研成果转化主要有:细胞智能方舱实验室、TIL细胞疗法、免疫细胞、干细胞、外泌体等。
旗下大模型平台:LIFESEEK 生命求索--国内基于Deep Seek的细胞产业全链条AI大模型平台。
